题目内容
氧化还原反应的实质是 氧化还原反应中氧化剂 电子,还原剂 电子.写出在呼吸面具中Na2O2起反应的化学方程式,并用双线桥法表示电子得失情况 该反应中氧化剂是 还原剂是 .
考点:氧化还原反应
专题:氧化还原反应专题
分析:氧化还原反应的实质是电子转移,化合价降低元素所在的反应物是氧化剂,发生还原反应,元素失去电子化合价升高,化合价升高数=化合价降低数=转移电子数.
解答:
解:氧化还原反应的实质是电子转移或电子对偏移,元素的化合价降低,发生的是还原反应,氧化还原反应中,元素失去电子化合价升高,化合价升高元素所在的反应物是还原剂,在Na2O2与H2O的反应中,化合价升高数=化合价降低数=转移电子数=2,电子转移情况为: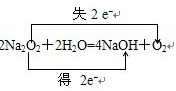 ,Na2O2既得电子又失电子,即是氧化剂又是还原剂;
,Na2O2既得电子又失电子,即是氧化剂又是还原剂;
故答案为:电子的得失或电子对偏移;得;失; ;Na2O2.
;Na2O2.
 ,Na2O2既得电子又失电子,即是氧化剂又是还原剂;
,Na2O2既得电子又失电子,即是氧化剂又是还原剂;故答案为:电子的得失或电子对偏移;得;失;
 ;Na2O2.
;Na2O2.
点评:本题考查学生氧化还原反应中的基本概念知识,要求学生熟记教材知识,灵活应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学原理的应用,主要是利用沉淀溶解平衡原理来解释的是( )
①灰粪共用损肥分;
②使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙对牙齿起到更好的保护作用
③溶洞、珊瑚的形成;
④水垢中Mg(OH)2的形成;
⑤误将钡盐[BaCl2、Ba(NO3)2]当做食盐食用后,常用0.5%的Na2SO4溶液解毒.
①灰粪共用损肥分;
②使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙对牙齿起到更好的保护作用
③溶洞、珊瑚的形成;
④水垢中Mg(OH)2的形成;
⑤误将钡盐[BaCl2、Ba(NO3)2]当做食盐食用后,常用0.5%的Na2SO4溶液解毒.
| A、①②③④ | B、②③⑤ |
| C、②③④⑤ | D、全部 |
25℃时,相同物质的量浓度下列溶液中,水的电离度由大到小排列顺序正确的是( )
①KNO3 ②NaOH ③NH4Ac ④NH4Cl.
①KNO3 ②NaOH ③NH4Ac ④NH4Cl.
| A、①>②>③>④ |
| B、④>③>①>② |
| C、③>④>②>① |
| D、③>④>①>② |
下列过程方向的判断的说法中错误的是( )
| A、NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| B、等物质的量的同一种物质在气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力能自发进行的反应过程,其体系的能量趋向于从高能状态转变为低能状态 |
| D、由能量判据和熵判据组合而成的复合判据,更适合于所有的反应过程 |
下列叙述中能肯定判断某化学平衡发生移动的是( )
| A、反应混合物的浓度的改变 |
| B、反应混合物中各组分的含量的改变 |
| C、正、逆反应速率的改变 |
| D、反应物的转化率的改变 |
当空气受SO2严重污染时,可通过飞机喷洒X粉末,使空气中的SO2含量明显降低,该过程发生的反应是2X+2SO2+O2=2CaSO4+2CO2.X的化学式是( )
| A、CaO |
| B、Na2CO3 |
| C、Ca(OH)2 |
| D、CaCO3 |
下列说法正确的是( )
| A、电负性最大的原子价电子构型:3S23p5 |
| B、N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型 |
| C、共价键和离子键都既有方向性又有饱和性 |
| D、根据VSEPR理论判断SF6空间构型为正八面体 |
