题目内容
下列说法正确的是( )
| A、电负性最大的原子价电子构型:3S23p5 |
| B、N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型 |
| C、共价键和离子键都既有方向性又有饱和性 |
| D、根据VSEPR理论判断SF6空间构型为正八面体 |
考点:原子核外电子排布,共价键的形成及共价键的主要类型,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A.电负性最大的原子是F;
B.原子数相同,电子总数相同的分子,互称为等电子体,等电子体的结构相似,据此分析;
C.离子键没有方向性和饱和性,而共价键有方向性和饱和性;
D.根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数分析解答.
B.原子数相同,电子总数相同的分子,互称为等电子体,等电子体的结构相似,据此分析;
C.离子键没有方向性和饱和性,而共价键有方向性和饱和性;
D.根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数分析解答.
解答:
解:A.电负性最大的原子是F,价电子构型:2S22p5,故A错误;
B.N3-和CO2互为等电子体,CO2为直线形的分子,所以N3-的空间构型为直线形,CO2和O3不互为等电子体,O3的空间构型为V形,故B错误;
C.离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,共价键是原子之间通过共用电子对形成,所以共价键有方向性和饱和性,故C错误;
D.SF6中心原子S原子成6个σ键、无孤对电子,价层电子对个数=σ键个数+孤电子对个数=6+0=6,杂化轨道数为6,采取d2sp3杂化,分子空间构型为正八面体,故D正确;
故选D.
B.N3-和CO2互为等电子体,CO2为直线形的分子,所以N3-的空间构型为直线形,CO2和O3不互为等电子体,O3的空间构型为V形,故B错误;
C.离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,共价键是原子之间通过共用电子对形成,所以共价键有方向性和饱和性,故C错误;
D.SF6中心原子S原子成6个σ键、无孤对电子,价层电子对个数=σ键个数+孤电子对个数=6+0=6,杂化轨道数为6,采取d2sp3杂化,分子空间构型为正八面体,故D正确;
故选D.
点评:本题综合性较大,考查了电负性、化学键的特点、杂化方式,注意把握分子中σ键和π键的判断方法,题目难度中等.

练习册系列答案
相关题目
下列烷烃的一氯取代物种没有同分异构体的是( )
| A、丙烷 | B、乙烷 |
| C、2-甲基丁烷 | D、3-甲基戊烷 |
下列说法正确的是( )
| A、酸性氧化物一定是非金属氧化物,金属氧化物一定是碱性氧化物 |
| B、氢气中氢元素的化合价为0,所以氢分子中没有化学键 |
| C、离子键只存在于离子化合物中,而共价键可能存在于离子化合物或共价化合物中 |
| D、往饱和NaCl溶液中先通CO2至饱和,再往溶液中通NH3至饱和,可析出大量NaHCO3固体 |
燃烧等质量的下列烃,生成CO2最多的是( )
| A、CH4 |
| B、C6H6 |
| C、C2H6 |
| D、C3H6 |
下列实验操作或实验原理的说法中正确的是( )
A、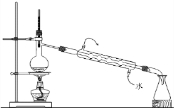 用如图装置进行蒸馏实验 用如图装置进行蒸馏实验 |
B、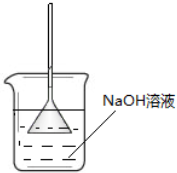 用如图装置吸收氯化氢气体 用如图装置吸收氯化氢气体 |
C、 用酒精提取溴水中的溴 用酒精提取溴水中的溴 |
D、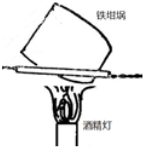 用如图装置灼烧小苏打制取少量的苏打 用如图装置灼烧小苏打制取少量的苏打 |
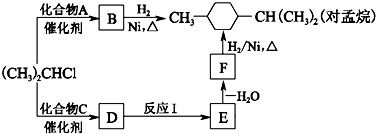
 (R为烷基,X为卤素原子)②RCH2CH2OH
(R为烷基,X为卤素原子)②RCH2CH2OH