题目内容
6.X、Y、Z、W、Q为短周期元素,在周期表中的位置如图所示.下列说法正确的是( )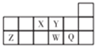
| A. | 离子Y2-和Z3+的核外电子排布相同 | |
| B. | X3-的离子半径小于Z3+的离子半径 | |
| C. | 元素Y的最高正价与最低负价绝对值之和为8 | |
| D. | 元素W的气态氢化物的稳定性比Q的强 |
分析 根据元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A.O2-、Al3+离子核外电子数均为10;
B.电子层结构相同,核电荷数越大,离子半径越小;
C.氧元素没有最高正化合价+6;
D.非金属性越强,对应的氢化物的稳定性越稳定.
解答 解:根据元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A.O2-、Al3+离子核外电子数均为10,二者核外电子排布相同,故A正确;
B.电子层结构相同,核电荷数越大,离子半径越小,故离子半径:N3->Al3+,故B错误;
C.Y为氧元素,没有最高正化合价+6,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增强,故D错误;
故选A.
点评 本题考查位置结构性质的相互关系及应用,难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
1.从海水中提取镁时,涉及不到的化学反应是( )
| A. | MgCl2+Ca(OH)2═CaCl2+Mg(OH)2↓ | B. | Mg(OH)2+2HCl═MgCl2+2H2O | ||
| C. | Mg(OH)2+H2SO4═MgSO4+2H2O | D. | MgCl2$\frac{\underline{\;通电\;}}{熔融}$Mg+Cl2↑ |
11.下列离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Mg(OH)2溶于硝酸:OH-+H+=H2O | |
| C. | Al与NaOH溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
18.下列说法不正确的是( )
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 0.1mol•L-1的NaHCO3溶液中C(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.1mol•L-1的NaHA溶液pH=5,则溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) | |
| D. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
15.将海水淡化我浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
回答下列问题:
(1)海水淡化的方法主要是②(填序号).
①过滤 ②蒸馏 ③萃取 ④蒸发
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O=NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,产品2的化学式为Mg(OH)2.1L浓海水最多可得到产品2的质量为69.6g.
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
回答下列问题:
(1)海水淡化的方法主要是②(填序号).
①过滤 ②蒸馏 ③萃取 ④蒸发
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O=NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
16.关于如图物质(商品名称为氟里昂-12)的叙述正确的是( )


| A. | 有两种同分异构体 | B. | 是平面型分子 | ||
| C. | 只有一种结构 | D. | 有四种同分异构体 |
 ,其一氯代物的结构简式是
,其一氯代物的结构简式是 ;其中一氯代物种类最多的是
;其中一氯代物种类最多的是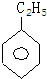 .(均填结构简式)
.(均填结构简式)