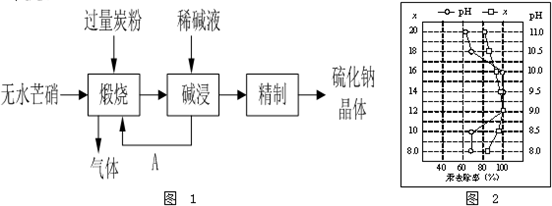
题目内容
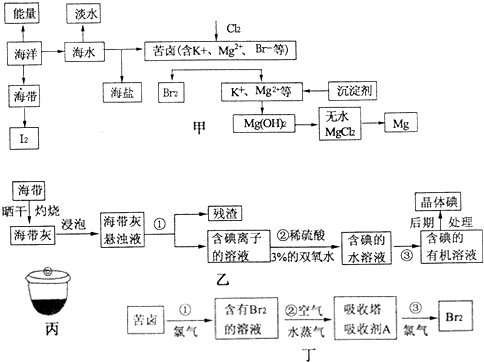
15.将海水淡化我浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.回答下列问题:
(1)海水淡化的方法主要是②(填序号).
①过滤 ②蒸馏 ③萃取 ④蒸发
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O=NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
分析 (1)海水淡化方法有海水冻结法、电渗析法、蒸馏法、反渗透法等,其中最常用的有蒸馏法、渗析法,海水淡化时使水与盐类物质分离,以此来解答;
(2)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(3)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量;
(4)电解熔融氯化镁得到Mg与氯气.
解答 解:(1)目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法,目前多采用多级闪急蒸馏法,故答案为:②;
(2)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×$\frac{1}{1+5}$×5=$\frac{5}{3}$mol,故答案为:$\frac{5}{3}$;
(3)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,
故答案为:Ca2++SO42-=CaSO4↓;Mg(OH)2;69.6;
(4)电解熔融氯化镁得到Mg与氯气,电解反应方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,难度中等.

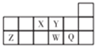
| A. | 离子Y2-和Z3+的核外电子排布相同 | |
| B. | X3-的离子半径小于Z3+的离子半径 | |
| C. | 元素Y的最高正价与最低负价绝对值之和为8 | |
| D. | 元素W的气态氢化物的稳定性比Q的强 |
| A. | AgCl沉淀生成和沉淀溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | AgCl在相同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| A. | 最高价氧化物的水化物的酸性甲比乙强 | |
| B. | 气态氢化物的稳定性甲比乙弱 | |
| C. | 阴离子的还原性甲比乙弱 | |
| D. | 甲的单质比乙的单质更易与氢气反应 |
| A. | 原子最外层电子数为2的元素一定是ⅡA元素 | |
| B. | 第三周期元素对应的离子半径从左往右依次减小 | |
| C. | 第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱 | |
| D. | 第三周期的主族元素的最高正价一定等于其最外层电子数 |
| A. | 乙醇和乙酸 | B. | 乙炔和乙醛 | C. | 乙烷和乙酸甲酯 | D. | 乙烯和乙醇 |