题目内容
19.异丙苯(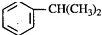 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空:(1)异丙苯的1H-NMR谱图中吸收峰的数目是5组.
(2)工业上主要通过苯与丙烯通过分子筛固体酸催化剂工艺获得异丙苯,写出其方程式为
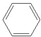 +
+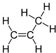 →
→ ,反应类型为加成反应.
,反应类型为加成反应.(3)α-甲基苯乙烯(
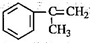 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示).
(用化学反应方程式表示).
分析 (1)该分子中有几种氢原子其吸收峰就有几组;
(2)苯和丙烯发生加成反应生成异丙苯;
(3)异丙苯先发生取代反应后发生消去反应得到α-甲基苯乙烯.
解答 解:(1)该分子中有几种氢原子其吸收峰就有几组,该分子中有5种氢原子,所以其吸收峰有5组,故答案为:5;
(2)苯和丙烯发生加成反应生成异丙苯,反应方程式为 +
+ →
→ ,为加成反应,故答案为:
,为加成反应,故答案为: +
+ →
→ ;
;
加成
(3)异丙苯制取制取α-甲基苯乙烯,可先发生取代反应生成氯代物,在碱性条件下发生消去反应可生成,故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析及知识运用能力,明确官能团及其性质关系是解本题关键,注意断键和成键方式,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
10.现有部分前四周期元素的性质或原子结构如表:
(1)写出元素E+基态原子的电子排布式:1s22s22p63s23p63d10.
(2)ABCD四种元素电负性由大到小排列顺序为(用元素符号表示)O>N>C>Si
(3)B单质分子中,含有σ键和π键的个数比是1:2,元素C的气态氢化物的杂化方式和空间构型分别为sp3、V形.
(4)以上元素组成的化合物中心原子是sp杂化方式的是CO2(化学式)
(5)A、B、C、D第一电离由大到小的顺序为(用元素符号表示):N>O>C>Si.
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
(2)ABCD四种元素电负性由大到小排列顺序为(用元素符号表示)O>N>C>Si
(3)B单质分子中,含有σ键和π键的个数比是1:2,元素C的气态氢化物的杂化方式和空间构型分别为sp3、V形.
(4)以上元素组成的化合物中心原子是sp杂化方式的是CO2(化学式)
(5)A、B、C、D第一电离由大到小的顺序为(用元素符号表示):N>O>C>Si.
7.下列说法正确的是( )
| A. | pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L | |
| B. | 常温时将pH=3的醋酸和pH=ll的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c( SO42-)+C( HCO3-)+c(OH-) |
14.下列有关化学用语的表示正确的是( )
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: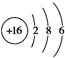 | |
| C. | 原子核内有18个中子的氯分子${\;}_{17}^{35}$Cl2 | |
| D. | CS2分子的结构式:S-C-S |
4.在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H1; 2H2(g)+O2(g)=2H2O(g)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
11.下列递变情况中正确的是( )
| A. | HF、HCl、HBr、HI的沸点依次升高 | B. | HF、HCl、HBr、HI还原性依次增强 | ||
| C. | HF、HCl、HBr、HI稳定性依次增强 | D. | HF、HCl、HBr、HI酸性依次增强 |
8.下列化学电池不易造成环境污染的是( )
| A. | 氢氧燃料电池 | B. | 干电池 | C. | 铅蓄电池 | D. | 锌锰电池 |
9.在CH3COOH?H++CH3COO-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |