题目内容
7.下列说法正确的是( )| A. | pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L | |
| B. | 常温时将pH=3的醋酸和pH=ll的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c( SO42-)+C( HCO3-)+c(OH-) |
分析 A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.常温下,醋酸是弱电解质、NaOH是强电解质,则pH=3的醋酸浓度大于pH=11的NaOH溶液,二者等体积混合时醋酸有剩余,溶液呈酸性;
C.在c(H+):c(OH-)=1:l012的溶液呈强碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,二者恰好反应生成硫酸钠、碳酸氢钠且二者的物质的量浓度相等,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,醋酸抑制水电离、氯化铵促进水电离,所以pH=5的NH4Cl溶液或醋酸中,前者水电离出的c(H+)为10-9 mol/L、后者水电离出的c(H+)为10-5mol/L,故A错误;
B.常温下,醋酸是弱电解质、NaOH是强电解质,则pH=3的醋酸浓度大于pH=11的NaOH溶液,二者等体积混合时醋酸有剩余,溶液呈酸性,则溶液的pH<7,故B错误;
C.在c(H+):c(OH-)=1:l012的溶液呈强碱性,离子之间不反应且和氢氧根离子不反应的能大量共存,这几种离子不反应且和氢氧根离子不反应,所以能大量共存,故C正确;
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,二者恰好反应生成硫酸钠、碳酸氢钠且二者的物质的量浓度相等,任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+2c( SO42-)+C( HCO3-)+c(OH-),故D错误;
故选C.
点评 本题考查离子浓度大小比较、水的电离、离子共存等知识点,为高频考点,明确溶液中溶质成分及其性质是解本题关键,注意弱电解质电离特点及影响弱电解质电离因素,易错选项是A.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| A. | 离子键 | B. | 氢键 | C. | 极性共价键 | D. | 非极性共价键 |
| A. | CH4、Cl2 | B. | CH3CH3、HCl | C. | CH≡CH、HCl | D. | CH2=CH2、HCl |
| A. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| B. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,金属性较强 |
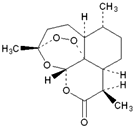 2015年我国女科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命而荣获诺贝尔奖.青蒿素结构式如图所示,下列关于青蒿素的说法不正确的是( )
2015年我国女科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命而荣获诺贝尔奖.青蒿素结构式如图所示,下列关于青蒿素的说法不正确的是( )| A. | 难溶于水,易溶于乙醚 | B. | 在热的NaOH溶液中可发生水解反应 | ||
| C. | 一定条件下能与氯气发生取代反应 | D. | 化学式为C15H21O5 |

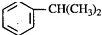 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: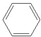 +
+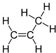 →
→ ,反应类型为加成反应.
,反应类型为加成反应.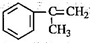 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示).
(用化学反应方程式表示).