题目内容
14.下列有关化学用语的表示正确的是( )| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: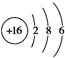 | |
| C. | 原子核内有18个中子的氯分子${\;}_{17}^{35}$Cl2 | |
| D. | CS2分子的结构式:S-C-S |
分析 A.溴化铵是离子化合物,由溴离子和铵根离子构成;
B.硫离子最外层有8个电子;
C.氯原子的质子数为17,中子数为18的氯原子的质量数为35;
D.CS2分子碳原子与两个硫原子分别共用2对电子;
解答 解:A.溴化铵是离子化合物,由溴离子和铵根离子构成,结合电子式书写方法写出的电子式为, ,故A错误;
,故A错误;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故B错误;
,故B错误;
C.氯原子的质子数为17,中子数为18的氯原子的质量数为35,则原子核内有18个中子的氯分子${\;}_{17}^{35}$Cl2,故C正确;
D.CS2分子碳原子与两个硫原子分别共用2对电子,存在2个C=S,结构式为:S=C=S,故D错误;
故选:C.
点评 本题考查了化学用语的规范应用和书写原则,主要是原子符号、离子结构示意图、结构式,掌握常见化学用语的概念及表示方法是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.按原子半径增大的顺序排列的一组是( )
| A. | Be、N、F | B. | Mg、Si、C | C. | Na、Mg、Ca | D. | Cl、S、P |
5.以氯乙烷为原料制备1,2-二溴乙烷,下列方案中合理的是( )
| A. | CH3CH2Cl$→_{H_{2}O}^{NaOH}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Cl$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
9.下列说法正确的是( )
| A. | CO2晶体和SiO2晶体中,微粒之间的化学键类型相同,晶体类型也相同 | |
| B. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 | |
| C. | 碘单质升华过程中不存在化学键被破坏的过程 | |
| D. | NaCl气体溶于水后,因为共价键被破坏,从而形成了Na+和Cl- |
3.下列各组指定原子序数的元素,能形成AB2型离子化合物的是( )
| A. | 6和8 | B. | 16和8 | C. | 12和9 | D. | 11和6 |
4.在铁板上滴加NaCl溶液,过一段时间后生锈.以下说法正确的是( )
| A. | 负极发生的反应为Fe-2e-=Fe3+ | |
| B. | 正极发生的反应为2H2O+O2+4e-=4OH- | |
| C. | Cl-向负极迁移 | |
| D. | 铁锈是Fe(OH)3 |

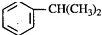 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: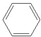 +
+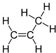 →
→ ,反应类型为加成反应.
,反应类型为加成反应.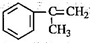 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示).
(用化学反应方程式表示).

 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.