题目内容
已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且S轨道电子数是P轨道电子数的两倍;C原子L层上有2对成对电子.M和W均有“生物金属”之称,M4+离子和氩原子的核外电子排布相同;W处于周期表中第8列.请回答下列问题:
(1)1mol B2A2分子中含σ键的数目是 .
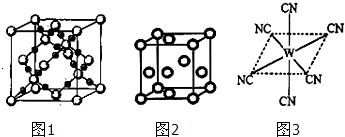
(2)BC2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图1所示.则该晶体的类型属于 晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为 .
(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图2.则晶胞中M原子的配位数为 ;若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为 cm.
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示.
①W元素基态原子价电子排布式为 .
②已知CN-与 (一种分子)互为等电子体,则1个CN-中π键数目为 .
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]-生成,则[D(OH)4]-中存在 .
a.共价键 b.配位键 c.σ键 d.π键.

(1)1mol B2A2分子中含σ键的数目是
(2)BC2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图1所示.则该晶体的类型属于
(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图2.则晶胞中M原子的配位数为
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示.
①W元素基态原子价电子排布式为
②已知CN-与
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]-生成,则[D(OH)4]-中存在
a.共价键 b.配位键 c.σ键 d.π键.
考点:晶胞的计算,原子核外电子排布,共价键的形成及共价键的主要类型,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;C原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以C为氧元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;D原子的最外层电子数等于其周期序数,D原子的电子层数是A的3倍,D为铝元素,M4+离子和氩原子的核外电子排布相同,则M为22号元素,是钛元素,W处于周期表中第8列,则为第ⅥⅡ族元素,且位于前四周期,则可知W为铁元素,据此答题.
解答:
解:A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;C原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以C为氧元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;D原子的最外层电子数等于其周期序数,D原子的电子层数是A的3倍,D为铝元素,M4+离子和氩原子的核外电子排布相同,则M为22号元素,是钛元素,W处于周期表中第8列,则为第ⅥⅡ族元素,且位于前四周期,则可知W为铁元素,所以A为氢元素;B为碳元素;C为氧元素;D为铝元素;M为钛元素;W为铁元素;
(1)B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024),故答案为:3 NA(或1.806×1024).
(2)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子轨道的杂化数为4,碳原子采取sp3杂化,故答案为:原子;sp3;
(3)金属钛是面心立方堆积方式,以立方体顶点的钛原子为例,距离它最近的钛原子分布在与之相连的面的面心上,这样的面有12个,所以钛的配位数为12,在每个钛的晶胞中含有钛原子数为8×
+6×
=4,设晶胞的连长为a,根据ρ=
有,ρ=
,所以a=
,故答案为:12;
;
(4)①Fe是26号元素,基态原子价电子排布式为3d64s2,故答案为:3d64s2;
②将C原子及1个电子用“N”代换可得CN-等电子体分子N2;CN-中存在C≡N三键,三键中有1个σ键,2个π键,所以1个CN-中π键数目为2,故答案为:N2;2;
(5)E为铝元素,光谱证实单质E与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键.所以,[Al(OH)4]-中存在共价键、配位键、δ键,
故选:abc.
(1)B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024),故答案为:3 NA(或1.806×1024).
(2)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子轨道的杂化数为4,碳原子采取sp3杂化,故答案为:原子;sp3;
(3)金属钛是面心立方堆积方式,以立方体顶点的钛原子为例,距离它最近的钛原子分布在与之相连的面的面心上,这样的面有12个,所以钛的配位数为12,在每个钛的晶胞中含有钛原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| a3 |
| 3 |
| ||
| 3 |
| ||
(4)①Fe是26号元素,基态原子价电子排布式为3d64s2,故答案为:3d64s2;
②将C原子及1个电子用“N”代换可得CN-等电子体分子N2;CN-中存在C≡N三键,三键中有1个σ键,2个π键,所以1个CN-中π键数目为2,故答案为:N2;2;
(5)E为铝元素,光谱证实单质E与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键.所以,[Al(OH)4]-中存在共价键、配位键、δ键,
故选:abc.
点评:本题以元素推断为载体,考查原子结构、电负性、电离能、化学键与晶体结构、晶胞的计算等知识,是对所学知识的综合考查与运用,难度不大,根据结构推断元素是解题关键.

练习册系列答案
相关题目
冶炼下列各组金属时,最适合用H2或CO把它从氧化物中还原出来的是( )
| A、Ca、Mg |
| B、Al、Fe |
| C、Fe、Cu |
| D、Hg、Ag |
下列与化学反应能量变化相关的叙述正确的是( )
| A、反应物的总能量一定高于生成物的总能量 |
| B、铝与氧化铁反应既是氧化还原反应,又是吸热反应 |
| C、化学反应中发生能量变化的根本原因是化学键的断裂与形成 |
| D、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O. (1)25°C时,NaOH和Na2CO3两溶液的pH均为11.
(1)25°C时,NaOH和Na2CO3两溶液的pH均为11. 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.