题目内容
9.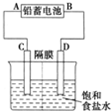 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO42--2e-═PbSO4
正极PbO2+4H++SO42-+2e-═PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为正极.
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g/cm3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子1mol.
②若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为22.4L.
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)$\frac{80a}{2300-73a}$×100%(用含a的代数式表示).
分析 (1)电解食盐水生成NaOH、氢气、氯气;
(2)在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,可知C为阳极;
(3)①标准状况下11.2 L Cl2的物质的量是$\frac{11.2L}{22.4L/mol}$=0.5 mol,结合化合价计算转移电子;
②结合Pb+PbO2+2H2SO4═2PbSO4+2H2O~2 e-~2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑计算;
③消耗a mol H2SO4,转移a mol电子,生成H2、Cl2、NaOH的物质的量分别为$\frac{a}{2}$mol、$\frac{a}{2}$mol、a mol,以此计算.
解答 解:(1)电解饱和食盐水的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)C极一侧滴酚酞试液不变红色,说明该极无OH-生成,C极是阳极,故A是正极,故答案为:正;
(3)①标准状况下11.2 L Cl2的物质的量是0.5 mol,每生成1 mol Cl2转移2 mol e-,故收集到11.2L(标准状况下)氯气,则至少转移电子为1 mol e-,
故答案为:1;
②铅蓄电池放电的总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,每消耗2 mol H2SO4,转移2 mol e-,可生成1 mol H2,标准状况时,H2的体积为1mol×22.4L/mol=22.4 L,
故答案为:22.4;
③Pb+PbO2+2H2SO4═2PbSO4+2H2O~2 e-~2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,消耗a mol H2SO4,转移a mol电子,生成H2、Cl2、NaOH的物质的量分别为$\frac{a}{2}$mol,$\frac{a}{2}$mol,a mol,故ω(NaOH)=$\frac{40a}{1000×1.15-\frac{a}{2}(71+2)}$×100%=$\frac{80a}{2300-73a}$×100%,故答案为:$\frac{80a}{2300-73a}$×100%.
点评 本题考查原电池及电解池的应用,为高频考点,把握发生的电解反应、物质的量关系为解答的关键,注意电解中电子守恒的应用,题目难度不大.

| A. | 氯化钠 | B. | 氨气 | C. | NH4Cl的电子式  | D. | 硫化钠 |
| A. | Si | B. | N | C. | O | D. | Ar |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 .
.(2)CO2中存在的化学键是共价键,CO2的电子式为
 .
.(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
