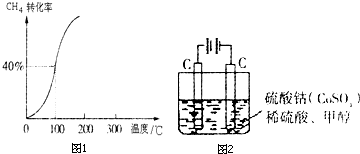
题目内容
取含MnO2的软锰矿17.4g,与足量浓HCl反应后,将生成的Cl2通入含22gNaBr的水溶液中,经加热蒸发水分并烘干后,得质量为13.1g的残渣.计算:
(1)生成NaCl多少克?
(2)MnO2与浓HCl反应生成Cl2多少克?
(3)软锰矿含MnO2的质量分数.
(1)生成NaCl多少克?
(2)MnO2与浓HCl反应生成Cl2多少克?
(3)软锰矿含MnO2的质量分数.
考点:化学方程式的有关计算
专题:计算题
分析:(1)(2)根据方程式Cl2+2NaBr=2NaCl+Br2,应用差量法解答生成NaCl的质量和参加反应的氯气的质量;
(3)得到氯气的体积,再根据 MnO2~~~Cl2,生成求二氧化锰的质量,软锰矿所含MnO2的质量分数为
×100%.
(3)得到氯气的体积,再根据 MnO2~~~Cl2,生成求二氧化锰的质量,软锰矿所含MnO2的质量分数为
| 二氧化锰的质量 |
| 软锰矿 |
解答:
解:(1)设参加反应的氯气的质量为m1,参加反应的溴化钠为a,生成氯化钠的质量为m2,
Cl2+2NaBr=2NaCl+Br2 质量差
71 206 117 160 89
m1 a m2 22-13.1=8.9g
&;=
=
=
,解得m1=7.1g,m2=11.7g,a=20.6g
答:生成NaCl的质量为11.7g;
(2)因为22g>20.6g,所以溴化钠过量,则生成的氯气完全反应,所以生成氯气7.1g,
答:生成氯气7.1g;
(3)设参加反应的二氧化锰的质量为m3,
MnO2~~~Cl2
87 71
m3 7.1g
解之得:m3=8.7g
软锰矿所含MnO2的质量分数为
×100%=50%,
答:软锰矿含MnO2的质量分数为50%.
Cl2+2NaBr=2NaCl+Br2 质量差
71 206 117 160 89
m1 a m2 22-13.1=8.9g
| 71 |
| m1 |
| 206 |
| a |
| 117 |
| m2 |
| 89 |
| 8.9 |
答:生成NaCl的质量为11.7g;
(2)因为22g>20.6g,所以溴化钠过量,则生成的氯气完全反应,所以生成氯气7.1g,
答:生成氯气7.1g;
(3)设参加反应的二氧化锰的质量为m3,
MnO2~~~Cl2
87 71
m3 7.1g
解之得:m3=8.7g
软锰矿所含MnO2的质量分数为
| 8.7 |
| 17.4 |
答:软锰矿含MnO2的质量分数为50%.
点评:本题考查化学方程式的相关计算,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能.下列热化学方程中,能直接表示出氯化钠晶体格能的是( )
| A、Na+(g)+Cl-(g)═NaCl(s);△H | ||
B、Na(s)+
| ||
| C、Na(s)═Na(g);△H2 | ||
| D、Na(g)-e-═Na+ (g);△H |
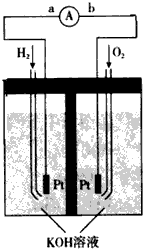 (1)氢氧燃料电池的能量转化主要形式是
(1)氢氧燃料电池的能量转化主要形式是