题目内容
(1)除去NO中混有少量NO2的最好方法是 ,除去N2中少量O2的方法最好是 .
(2)4.8g镁在氧气中燃烧时质量增加3.2g,而相同质量的镁在空气中燃烧时,质量增加却小于3.2g.试分析其原因是 .
(2)4.8g镁在氧气中燃烧时质量增加3.2g,而相同质量的镁在空气中燃烧时,质量增加却小于3.2g.试分析其原因是
考点:氮的氧化物的性质及其对环境的影响,镁的化学性质
专题:元素及其化合物
分析:(1)根据除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,一氧化氮中的二氧化氮可以通过盛水的洗气瓶除去;除去N2中少量O2的方法最好是通过灼热的铜网除去;
(2)在氧气中燃烧只生成氧化镁:2Mg+O2
2MgO,24g镁可生成40g氧化镁,4.8g镁在氧气中燃烧质量增加3.2g.
在氮气中燃烧产生氮化镁:3Mg+N2
Mg3N2,72g镁可生成100g氮化镁,4.8g镁燃烧质量增加1.87g.
在二氧化碳中燃烧产生碳和氧化镁:2Mg+CO2
C+2MgO,24g镁可生成40g氧化镁和6g碳,4.8g镁在二氧化碳气体中燃烧固体质量增加4.4g.
据此发分析判断.
(2)在氧气中燃烧只生成氧化镁:2Mg+O2
| ||
在氮气中燃烧产生氮化镁:3Mg+N2
| ||
在二氧化碳中燃烧产生碳和氧化镁:2Mg+CO2
| ||
据此发分析判断.
解答:
解:(1)因NO2能与水反应生成硝酸和NO,NO不与水反应,所以可用水除去NO中混有的NO2,除去N2中少量O2的方法最好是通过灼热的铜网除去;
故答案为:将气体通过盛有水的洗气瓶;将气体通过灼热的铜网;
(2)在氧气中燃烧只生成氧化镁:2Mg+O2
2MgO,24g镁可生成40g氧化镁,4.8g镁在氧气中燃烧质量增加3.2g.
在氮气中燃烧产生氮化镁:3Mg+N2
Mg3N2,72g镁可生成100g氮化镁,4.8g镁燃烧质量增加1.87g.
在二氧化碳中燃烧产生碳和氧化镁:2Mg+CO2
C+2MgO,24g镁可生成40g氧化镁和6g碳,4.8g镁在二氧化碳气体中燃烧固体质量增加4.4g.
在空气中燃烧,由于二氧化碳极微量,因此主要发生镁和氧气以及镁和氮气的反应,相同质量的镁在空气中燃烧部分和氮气反应生成固体质量比在氧气中燃烧生成的固体质量小;
故答案为:相同质量的镁在空气中燃烧部分和氮气反应生成固体质量比在氧气中燃烧生成的固体质量小;
故答案为:将气体通过盛有水的洗气瓶;将气体通过灼热的铜网;
(2)在氧气中燃烧只生成氧化镁:2Mg+O2
| ||
在氮气中燃烧产生氮化镁:3Mg+N2
| ||
在二氧化碳中燃烧产生碳和氧化镁:2Mg+CO2
| ||
在空气中燃烧,由于二氧化碳极微量,因此主要发生镁和氧气以及镁和氮气的反应,相同质量的镁在空气中燃烧部分和氮气反应生成固体质量比在氧气中燃烧生成的固体质量小;
故答案为:相同质量的镁在空气中燃烧部分和氮气反应生成固体质量比在氧气中燃烧生成的固体质量小;
点评:本题考查物质的除杂,物质燃烧过程中故质量的变化计算分析,难度不大,注意二氧化氮能与水反应,镁在空气中燃烧和氧气、氮气、二氧化碳能发生法,化学方程式的固体质量变化计算是解题的关键

练习册系列答案
相关题目
 一首脍炙人口的民歌《茉莉花》唱得沁人心脾,茉莉醛具有浓郁的茉莉花香,其结构简式如图所示.关于茉莉醛的下列叙述正确的是( )
一首脍炙人口的民歌《茉莉花》唱得沁人心脾,茉莉醛具有浓郁的茉莉花香,其结构简式如图所示.关于茉莉醛的下列叙述正确的是( )| A、茉莉醛与苯甲醛互为同系物 |
| B、在加热和催化剂作用下加氢,每摩尔茉莉醛最多能消耗3mol氢气 |
| C、一定条件下,茉莉醛能发生氧化、还原、酯化等反应 |
| D、从理论上说,202g茉莉醛能从足量银氨溶液中还原出216g银 |
几种物质的熔点如下表:
据此作出的下列判断中错误的是( )
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点/℃ | 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
| A、铝的化合物的晶体中,有的是离子晶体 |
| B、表中物质里只有BCl3和CO2的晶体是分子晶体 |
| C、同主族元素的氧化物可能形成不同类型的晶体 |
| D、不同主族元素的氧化物可能形成相同类型的晶体 |
采用下列装置和操作,能达到实验目的是( )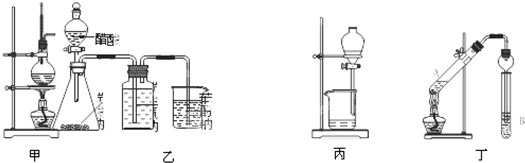

| A、甲装置:加热浓硫酸和乙醇(其体积为比3:1)混合液,制取乙烯 |
| B、乙装置:比较醋酸、碳酸、苯酚三者的酸性强弱 |
| C、丙装置:向混有苯酚的苯中加入NaOH溶液,除去其中的苯酚 |
| D、丁装置:A中为乙醇、醋酸,B为饱和碳酸钠溶液,制取乙酸乙酯 |
下列说法不正确的是( )
| A、不可通过核磁共振氢谱鉴别苯酚和环己醇 |
| B、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D、米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 |
某金属与氯元素形成的化合物中,质量比为1:1.9,原子个数之比为1:3,则金属的相对原子质量为( )
| A、27 | B、56 | C、23 | D、64 |