题目内容
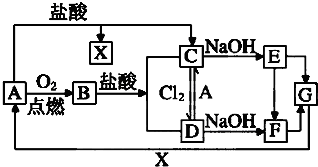 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.(1)写出A、C、F、G的化学式A、
(2)检验D中阳离子的方法
(3)保存C溶液时为什么要加固体A
(4)写出下列转化的离子方程式或化学方程式.
①A→C:
考点:无机物的推断
专题:推断题
分析:A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,据此解答.
解答:
解:A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,
(1)由上述分析可知,A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,
故答案为:Fe;FeCl2;Fe(OH)3;Fe2O3.
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+,
故答案为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+;
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化;
(4)①A→C的反应离子方程式为:Fe+2H+=Fe2++H2↑,
②C→D的反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-.
(1)由上述分析可知,A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,
故答案为:Fe;FeCl2;Fe(OH)3;Fe2O3.
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+,
故答案为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+;
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化;
(4)①A→C的反应离子方程式为:Fe+2H+=Fe2++H2↑,
②C→D的反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查无机物推断,涉及Fe元素单质化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断各物质,掌握元素化合物的性质是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、FeBr3溶液中加入过量的氯水 2Fe2++4Br-+3Cl2=2Br2+6Cl-+2Fe3+ |
| B、向小苏打溶液中加入醋酸 CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
| C、向碳酸钠溶液中加入少量氯水 CO32-+2H+=CO32-+H2O |
| D、用碳酸钠溶液吸收少量二氧化硫 2CO32-+SO2+H2O=2HCO3-+SO32- |
下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是( )
| A、V(H2)═0.1mol/(L?min) |
| B、V(N2)═0.1mol/(L?min) |
| C、V(NH3)═0.15mol/(L?min) |
| D、V(N2)═0.002mol/(L?s) |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,下列说法正确的是( )
| A、Na2B溶液一定有:c(OH-)>c(H+)+c(HB-) |
| B、Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性 |
| C、NaHB溶液一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) |
| D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
 下面a~e是中学化学实验中常见的几种定量仪器:
下面a~e是中学化学实验中常见的几种定量仪器: ⑤CH≡CH
⑤CH≡CH