题目内容
19.化学在工业上的应用十分广泛.请回答下列问题:(1)工业上生产玻璃、水泥和炼铁都要用到的原料是(填名称)石灰石,工业炼铁主要设备是炼铁高炉.
(2)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式)Ca(ClO)2.
(3)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域.其制取原理为:Al2O3+N2+3C$\stackrel{高温}{→}$2AlN+3CO 由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质.为测定该产品中A1N的质量分数,进行了以下实验:
称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①AlN跟NaOH溶液反应的化学方程式为AlN+NaOH+H2O═NaAlO2+NH3↑;
②该样品中的A1N的质量分数为61.5%.
分析 (1)从碳酸钙的性质着手分析,石灰石的主要成分是碳酸钙,高温下碳酸钙和二氧化硅能发生化学反应,据此分析,炼铁的主要设备是高炉;
(2)氯气与石灰乳反应生成氯化钙和次氯酸钙,漂白粉的有效成分为次氯酸钙;
(3)①由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,据此配平书写反应方程式;
②生成0.15molNH3,根据氮元素守恒可知10g样品中含有AlN的物质的量为0.15mol,根据m=nM计算AlN的质量,再根据质量分数定义计算.
解答 解:(1)生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;
生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥,
同时,石灰石还是炼铁的一种原料(造渣材料),所以在炼铁、制玻璃、制水泥三种工业生产中都用到的原料是石灰石;炼铁在炼铁高炉中进行,
故答案为:石灰石; 炼铁高炉;
(2)氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
其中氯化钙和次氯酸钙的混合物为漂白粉的成分,氯化钙无漂白作用,漂白粉的有效成分为次氯酸钙,
故答案为:Ca(ClO)2;
(3)①由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
②生成NH3的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mo,根据氮元素守恒可知10g样品中含有AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g,该样品中的AlN的质量分数为$\frac{6.15g}{10g}$×100%=61.5%,
故答案为:61.5%.
点评 本题考查了硅酸盐工业的原料和漂白粉的制取、有效成分等问题,并考查了混合物计算,难度不大,注意利用守恒思想进行的计算.

| A. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
| A. | 用澄清石灰水区别SO2和CO2 | |
| B. | 用酸性KMnO4溶液区分苯和乙烯 | |
| C. | 用新制Cu(OH)2悬浊液区分蔗糖和葡萄糖 | |
| D. | 用加热的方式区别碳酸钠和碳酸氢钠 |
| a | |||||||||||||||||
| b | c | d | e | ||||||||||||||
| f | g | h | |||||||||||||||

(2)由元素a、d、f组成的化合物存在的化学键是C(A 离子键 B 共价键 C离子键和共价键) (填序号)
(3)由f的最高价氧化物的水化物和h的最高价氧化物的水化物反应的离子方程式是H++OH-=H2O.
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ba(OH)2溶液中加入H2SO4溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向Na2CO3溶液中加入少量稀H2SO4溶液:CO32-+2H+═CO2↑+H2O | |
| D. | SO2与碘水的反应:SO2+2H2O+I2═SO42-+2I-+4H+ |
①检查装置气密性后,在各仪器中添加相应试剂.
②打开弹簧夹K1~K4,通入一段时间N2,将T型管插入B中,继续通入N2,然后关闭K1、K3、K4.
③打开活塞a,滴加一定量的浓盐酸,加热A.
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
⑦更换试管D,重复过程⑤,检验B溶液中的离子.
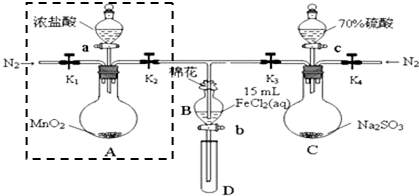
试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好.
(2)C中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+.
(4)B中的棉花通常会浸润NaOH溶液试剂;实验②中通入N2的作用是排除装置中的空气,防止FeCl2溶液被O2氧化.
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.某同学设计如下实验,证实该假设成立:
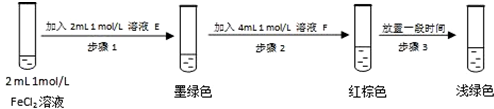
①溶液E和F分别为Na2SO3(或可溶性亚硫酸盐)、FeCl3.
②请结合方程式和化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因Fe3+与SO32-反应Fe3++SO32-=Fe2++SO42-,使c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色.
| A. | 常温下,0.1 mol•L-1 CH3COOH溶液的pH=3 | |
| B. | CH3COOH溶液能和NaOH溶液反应 | |
| C. | 往CH3COOH溶液中加入几滴石蕊试液,溶液变红色 | |
| D. | 0.1 mol•L-1CH3COOH溶液做导电性实验,灯光较暗 |