题目内容
7.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | ||||||||||||||
| f | g | h | |||||||||||||||

(2)由元素a、d、f组成的化合物存在的化学键是C(A 离子键 B 共价键 C离子键和共价键) (填序号)
(3)由f的最高价氧化物的水化物和h的最高价氧化物的水化物反应的离子方程式是H++OH-=H2O.
分析 由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为F、f为Na、g为Mg、h为S.
(1)元素d的最低价的氢化物为H2O,氧原子与H原子之间形成1对共用电子对;
(2)由元素a、d、f组成的化合物为NaOH;
(3)由f的最高价氧化物的水化物为NaOH、h的最高价氧化物的水化物为H2SO4,二者反应生成硫酸钠与水.
解答 解:由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为F、f为Na、g为Mg、h为S.
(1)元素d的最低价的氢化物为H2O,电子式为 ,故答案为:
,故答案为: ;
;
(2)由元素a、d、f组成的化合物为NaOH,含有离子键、共价键,故选:C;
(3)由f的最高价氧化物的水化物为NaOH、h的最高价氧化物的水化物为H2SO4,二者反应生成硫酸钠与水,反应离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O.
点评 本题考查元素周期表、常用化学用语、化学键等,比较基础,需要学生熟练掌握元素周期表.

练习册系列答案
相关题目
17.下列物质中属于纯净物,化合物,盐,钙盐的是( )
| A. | 石灰水 | B. | Ca(OH)2 | C. | CaCO3 | D. | H2O |
18.下列说法不正确的是( )
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
15.下列措施不能增大反应速率的是( )
| A. | 升高温度 | B. | 使用合适的催化剂 | ||
| C. | 提高反应物浓度 | D. | 降低温度 |
2.下列方程式表达正确的是( )
| A. | 铁与稀盐酸反应的离子方程式:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na与水反应的离子方程式:Na+H20═Na++OH-+H2↑ | |
| C. | FeCl3中加入统分的离子方程式:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 醋酸的电离方程式:CH3COOH═CH3COO-+H+ |
12.下列说法不正确的是( )
| A. | 工业制硫酸时用到的主要设备有沸腾炉、接触室、吸收塔 | |
| B. | 可用KSCN溶液检验某溶液中是否存在Fe3+ | |
| C. | 相同条件下同体积同浓度的盐酸分别与等质量的碳酸钠、碳酸氢钠固体反应,后者速率快 | |
| D. | 铝粉可与氧化镁在高温下发生铝热反应 |
16.在恒容密闭容器中加入一定量的反应物后存在下列平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法正确的是( )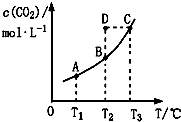
CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法正确的是( )

| A. | 该反应的△H<0 | |
| B. | 在T2时,D点的反应速率:ν(正)<(逆) | |
| C. | A、C两点相比,混合气体的平均相对分子质量:M(A)<M(C) | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1>K2 |
17.下列各组离子,在指定环境中一定能大量共存的是( )
| A. | 在能使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 在含有S2-离子的溶液中:NH4+、K+、Cl-、SO42- | |
| C. | 在由水电离出的c(H+)=10-12mol•L-1的溶液中Na+、Ba2+、Cl- | |
| D. | 在无色溶液中:NH4+、Mg2+、SO42-、SiO32- |