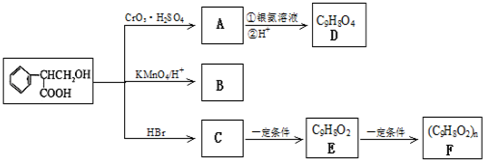
题目内容
A~I分别代表中学化学中常见的物质,他们之间的相互关系如图所示(部分反应物、生成物没有列出).且已知G为既可与强酸反应又可与强碱反应的金属氧化物,A~F六种物质中均含同一种元素.
(1)1 mol A与水在高温下反应转移的电子数为 .
(2)写出反应⑤的粒子方程式: .
(3)反应⑥的现象为 ,其反应的化学方程式为 .
(4)请举例说明反应①的一个应用: .
(5)①~⑥的反应中属于氧化还原反应的是 .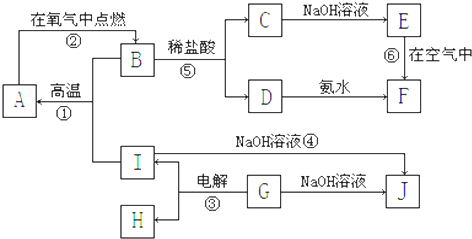
(1)1 mol A与水在高温下反应转移的电子数为
(2)写出反应⑤的粒子方程式:
(3)反应⑥的现象为
(4)请举例说明反应①的一个应用:
(5)①~⑥的反应中属于氧化还原反应的是

考点:无机物的推断
专题:推断题
分析:A~I分别代表中学化学中常见的物质,G为既可与强酸反应又可与强碱反应的金属氧化物,则G为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,A为金属,B为氧化物,与盐酸反应生成的C和D为氯化物,E和F为氢氧化物,且E可转化为F,可知E为Fe(OH)2,F为Fe(OH)3,则D为FeCl3,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,据此答题.
解答:
解:A~I分别代表中学化学中常见的物质,G为既可与强酸反应又可与强碱反应的金属氧化物,则G为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,A为金属,B为氧化物,与盐酸反应生成的C和D为氯化物,E和F为氢氧化物,且E可转化为F,可知E为Fe(OH)2,F为Fe(OH)3,则D为FeCl3,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,
(1)铁与水在高温下反应生成四氧化三铁,所以1mol铁反应转移的电子数为2.67NA,
故答案为:2.67NA;
(2)四氧化三铁中有+2价铁和+3价铁,与盐酸反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;
(3)反应⑥为Fe(OH)2被氧化生成Fe(OH)3的反应,反应的方程式为4Fe(OH)2+O2+2H2O=Fe(OH)3,该反应过程中观察到的明显现象是白色沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=Fe(OH)3;
(4)反应①为铝热反应,工业常用来焊接铁轨,
故答案为:焊接铁轨;
(5)根据反应中元素化合价的变化情况可知,在①~⑥的反应中属于氧化还原反应的是①②③④⑥,在这些反应中都元素的化合价发生变化,
故答案为:①②③④⑥.
(1)铁与水在高温下反应生成四氧化三铁,所以1mol铁反应转移的电子数为2.67NA,
故答案为:2.67NA;
(2)四氧化三铁中有+2价铁和+3价铁,与盐酸反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;
(3)反应⑥为Fe(OH)2被氧化生成Fe(OH)3的反应,反应的方程式为4Fe(OH)2+O2+2H2O=Fe(OH)3,该反应过程中观察到的明显现象是白色沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=Fe(OH)3;
(4)反应①为铝热反应,工业常用来焊接铁轨,
故答案为:焊接铁轨;
(5)根据反应中元素化合价的变化情况可知,在①~⑥的反应中属于氧化还原反应的是①②③④⑥,在这些反应中都元素的化合价发生变化,
故答案为:①②③④⑥.
点评:本题考查无机物的推断,侧重于学生的分析能力和元素化合物知识的综合运用的考查,物质的推断是解题的关键,中等难度,答题时注意把握推断题的突破口,学会灵活运用常见的元素化合物知识.

练习册系列答案
相关题目
能用H++OH-=H2O表示的是( )
| A、NaOH溶液和CO2的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、NaOH溶液和盐酸反应 |
| D、氨水和盐酸的反应 |
电离常数(Ka和Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的运算或运用正确的是( )
| A、某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×l0-8.60 |
| B、Ka( HCN)<Ka( CH3COOH).说明同浓度时氢氰酸的酸性比醋酸强 |
| C、Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀 |
| D、Ksp( AgBr)<Ksp( AgCl),说明AgBr和AgCl均不溶于稀硝酸 |
下列变化过程一定需要加入还原剂才能实现的是( )
| A、KClO3→KCl |
| B、CO2→C |
| C、Fe→Fe2+ |
| D、NaCl→HCl |
下列鉴别方法不可行的是( )
| A、用光照的方法鉴别硫酸铜溶液和氢氧化铁胶体 |
| B、用稀硫酸来鉴别BaCl2、NaCl、Na2CO3三种溶液 |
| C、用BaCl2溶液和稀硝酸来鉴别Na2SO4和AgNO3两种溶液 |
| D、用CCl4来鉴别FeCl3溶液和碘水 |