题目内容
14.下列说法或者方程式正确的是( )| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2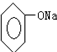 +H2O+CO2→2 +H2O+CO2→2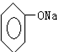 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
分析 A.酚酞试液在碱性溶液中变红;
B.向CH3COOH溶液中滴加NaOH的过程中,乙酸根离子物质的量逐渐增大,乙酸、氢氧根离子物质的量逐渐减小;
C.苯酚钠溶液和二氧化碳反应生成苯酚和碳酸氢钠;
D.二价铁离子被硝酸根氧化生成三价铁离子,硝酸根被还原为NO.
解答 解:A.Cl-,S2-,SO32-,K+,在碱性溶液中不反应,可以大量共存,故A错误;
B.向CH3COOH溶液中滴加NaOH的过程中,CH3COOH+NaOH=CH3COONa+H2O,乙酸根离子物质的量逐渐增大,乙酸、氢氧根离子物质的量逐渐减小,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终增大,最终不变,故B错误;
C.酸性H2CO3>C6H5OH>HCO3-,所以苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,故C错误;
D.向硝酸亚铁溶液中滴加盐酸,离子方程式:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写,为高考频考点,熟悉反应实质及离子方程式书写方法是解题关键,注意硝酸根离子在酸性环境下具有强的氧化性,题目难度中等.

练习册系列答案
相关题目
5. 向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
 向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )| A. | 0.005 mol•L-1 | B. | 0.01 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.1 mol•L-1 |
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 过氧化钠与水反应时,生成0.1mol氧气,转移电子数为0.2NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中,含有的H+离子数为2NA | |
| C. | 常温常压下,1mol氦气含有的原子数为2NA | |
| D. | 标准状况下,11.2L水含有的分子数为0.5NA |
6.常温下,下列不发生反应的一组物质是( )
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱 ⑤铁与液氧 ⑥一氧化氮与氧气 ⑦硅与氧气.
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱 ⑤铁与液氧 ⑥一氧化氮与氧气 ⑦硅与氧气.
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ①④⑤⑦ | D. | ①②③⑦ |
 .
.