题目内容
温度一定,在一个密闭容器内,发生合成氨反应:N2+3H2?2NH3.若充入1molN2和3molH2,反应达到平衡时NH3的体积百分含量为W%.若改变开始时投入原料的量,加入amolN2,bmolH2,cmolNH3,反应达到平衡时,NH3的体积百分含量仍为W%,则:
①若温度、容器体积恒定a=b=0,c=
若温度、压强恒定a=b=0,c
②若温度、容器体积恒定a=0.75,b= ,c=
若温度、压强恒定a=0.75,b ,c
③若温度、容器体积恒定,则 a、b、c之间必须满足的关系是 若温度、压强恒定,则 a、b、c之间必须满足的关系是 .
①若温度、容器体积恒定a=b=0,c=
若温度、压强恒定a=b=0,c
②若温度、容器体积恒定a=0.75,b=
若温度、压强恒定a=0.75,b
③若温度、容器体积恒定,则 a、b、c之间必须满足的关系是
考点:等效平衡
专题:化学平衡专题
分析:由于反应N2+3H2?2NH3是体积减小 的反应,要使NH3的体积百分含量仍为W%,则在恒温恒容条件下,必须满足完全等效,即全部折算成氮气和氢气,分别为1mol和3mol,在恒温恒压条件下,必须满足成比例等效,即氮气和氢气的物质的量之比为1:3,据此答题.
解答:
解:由于反应N2+3H2?2NH3是体积减小 的反应,要使NH3的体积百分含量仍为W%,则在恒温恒容条件下,必须满足完全等效,即全部折算成氮气和氢气,分别为1mol和3mol,在恒温恒压条件下,必须满足成比例等效,即氮气和氢气的物质的量之比为1:3,
①若温度、容器体积恒定a=b=0,相当于1molN2和3molH2全部生成氨气,则c=2,若温度、压强恒定a=b=0,相当于容器中全部是氨气,此时生成的氮气和氢气始终是1:3,都符合题意,所以c>0即可,故答案为:2;>0;
②若温度、容器体积恒定a=0.75,满足完全等效,即全部折算成氮气和氢气,分别为1mol和3mol,则有b=2.25,c=0.5;若温度、压强恒定a=0.75,满足成比例等效,即氮气和氢气的物质的量之比为1:3,则有b=2.25,c>0,故答案为:2.25,0.5;2.25,>0;
③若温度、容器体积恒定,amolN2,bmolH2,cmolNH3,全部折算成氮气和氢气分别为a+
c、b+
c,满足完全等效,即全部折算成氮气和氢气,分别为1mol和3mol,则有a+
c=1、b+
c=3,若温度、压强恒定,amolN2,bmolH2,cmolNH3,全部折算成氮气和氢气分别为a+
c、b+
c,满足成比例等效,即氮气和氢气的物质的量之比为1:3,则有(a+
c):(b+
c)=3:1,故答案为:a+
c=1、b+
c=3;(a+
c):(b+
c)=3:1;
①若温度、容器体积恒定a=b=0,相当于1molN2和3molH2全部生成氨气,则c=2,若温度、压强恒定a=b=0,相当于容器中全部是氨气,此时生成的氮气和氢气始终是1:3,都符合题意,所以c>0即可,故答案为:2;>0;
②若温度、容器体积恒定a=0.75,满足完全等效,即全部折算成氮气和氢气,分别为1mol和3mol,则有b=2.25,c=0.5;若温度、压强恒定a=0.75,满足成比例等效,即氮气和氢气的物质的量之比为1:3,则有b=2.25,c>0,故答案为:2.25,0.5;2.25,>0;
③若温度、容器体积恒定,amolN2,bmolH2,cmolNH3,全部折算成氮气和氢气分别为a+
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
点评:本题主要考查恒温恒容和恒温恒压条件下的等效平衡,难度不大,具有代表性,解题时注意等效思想的运用.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列物质按照酸、碱、盐、氧化物的顺序排列的是( )
| A、盐酸、纯碱、硫酸亚铁、生石灰 |
| B、硫酸、熟石灰、硝酸钾、五氧化二磷 |
| C、氢硫酸、消石灰、干冰、硫酸铜 |
| D、硝酸、苛性纳、碱式碳酸铜、熟石灰 |
下列实验装置设计正确且能达到相应实验目的是( )
A、 石油分馏 |
B、 制备乙酸乙酯 |
C、 铁制品表面镀锌 |
D、 构成银锌原电池 |
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用.铅蓄电池在放电和充电时发生的化学反应可用下式表示:
Pb+PbO2+2H2SO4
2PbSO4+2H2O据此判断下列叙述正确的是( )
Pb+PbO2+2H2SO4
| 放电 |
| 充电 |
| A、放电时负极电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| B、充电时阴极电极反应式为:PbSO4+2e-=Pb+SO42- |
| C、充电时,若要使1mol PbSO4转变为Pb和PbO2,则需要通过2mol电子 |
| D、放电时,H+向负极移动 |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.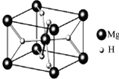 MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为
MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为