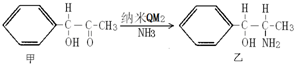
题目内容
5.在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )| A. | C(Ba2+)=C(SO42-)=Ksp½ | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) | |
| D. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C C(SO42-) |
分析 在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,存在沉淀溶解平衡:BaSO4(s)?Ba2++SO42-;若以Ksp表示BaSO4的溶度积,则Ksp=[c(Ba2+)•c(SO42-),饱和溶液中c(Ba2+)=c(SO42-),加入氯化钡溶液增大钡离子浓度,沉淀溶解平衡向生成沉淀的方向进行,硫酸根离子浓度减小,溶度积常数随温度变化,不随浓度改变.
解答 解:A.加入氯化钡溶液会生成硫酸钡沉淀,但溶液中钡离子浓度和硫酸根离子浓度不再相等,故A错误;
B.加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,最后溶液中的溶度积常数不变,故B错误;
C.加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,钡离子浓度大于硫酸根离子浓度,最后溶液中的溶度积常数不变,即c(Ba2+)•c(SO42-)=Ksp c(Ba2+)>c(SO42-),故C正确;
D.溶度积常数是随温度变化不随浓度改变,最后溶液中的溶度积常数不变,钡离子浓度大于硫酸根离子浓度,故D错误;
故选C.
点评 本题考查了沉淀溶解平衡的建立和影响因素,题目难度不大,注意掌握溶解平衡及其影响为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18 g H216O和20 g H218O含有的质子数均为10NA | |
| B. | 1L 1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
13.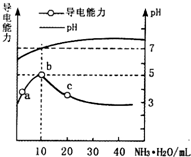 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 |
15.下列属于氧化物的是( )
| A. | H2SO4 | B. | Ca(OH)2 | C. | KClO3 | D. | CO 2 |
 )
)
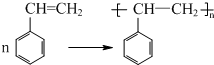 (不要求写出反应条件)
(不要求写出反应条件)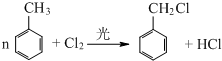 (要求写出反应条件)
(要求写出反应条件)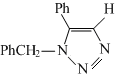 .
.
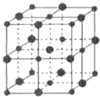 已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.
已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.