题目内容
15.下列叙述正确的是( )| A. | 在醋酸溶液中加入少量NaHSO4固体,醋酸的电离平衡左移,且溶液中的c(H+)减小 | |
| B. | 加热蒸干并灼烧硝酸铝溶液,最终得到的固体是Al(NO3)3 | |
| C. | 常温下,将 pH=1的醋酸溶液稀释1000倍,测得 pH=4 | |
| D. | 熵增加且放热的反应一定是自发反应 |
分析 A、NaHSO4是强电解质,在溶液中能完全电离为钠离子、氢离子和硫酸根;
B、Al(NO3)3水解出的硝酸是挥发性酸;
C、醋酸是弱电解质,加水稀释,其电离平衡向右移;
D、G=△H-T•△S<0的反应为自发进行的反应.
解答 解:A、NaHSO4是强电解质,在溶液中能完全电离为钠离子、氢离子和硫酸根,故向醋酸溶液中加入NaHSO4固体后,溶液中的c(H+)增大,醋酸的电离平衡左移,故A错误;
B、Al(NO3)3溶液的水解反应为:Al(NO3)3+3H2O?Al(OH)3+3HNO3,由于其水解生成的硝酸是挥发性酸,加热时硝酸挥发导致水解平衡右移,水解被促进,则蒸干后得到Al(OH)3,灼烧后氢氧化铝分解为Al2O3,即最终得到的是Al2O3,故B错误;
C、醋酸是弱电解质,加水稀释,其电离平衡向右移,会电离出更多的氢离子,故将 pH=1的醋酸溶液稀释1000倍,测得pH<4,故C错误;
D、G=△H-T•△S<0的反应为自发进行的反,故熵增加且放热的反应的G一定小于0,故一定自发进行,故D正确.
故选D.
点评 本题考查了弱电解质电离平衡的移动和盐类水解的应用,本题难度不大,应注意的是弱酸加水稀释时pH的变化程度较强酸的小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.将Na投入FeCl3溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀,有气泡产生 | ||
| C. | 有铁生成 | D. | 无变化 |
3.下列关于氧化还原反应的说法中不正确的是( )
| A. | 有单质参加的化合反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
20.下列事实中,不能用勒夏特列原理加以解释的是( )
| A. | 醋酸溶液加水稀释醋酸的电离程度增大 | |
| B. | 工业合成氨时常用通过过量的氮气的方法提高氢气的转化率 | |
| C. | 新制的氯水在光照的条件下颜色变浅 | |
| D. | 氯化铁溶液中加Fe粉振荡后颜色变浅 |
7.下列试剂储存说法不正确的是( )
| A. | 金属钠存放在盛有煤油的试剂瓶中 | |
| B. | 烧碱盛放在玻璃瓶塞的磨口玻璃瓶中 | |
| C. | 存放液溴的试剂瓶中应加水封 | |
| D. | 漂白粉置于冷暗处密封保存 |
4.下列物质中,能使酸性KMnO4溶液褪色的是( )
①乙烯 ②乙烷 ③乙苯 ④乙醇 ⑤乙酸 ⑥聚乙烯 ⑦苯.
①乙烯 ②乙烷 ③乙苯 ④乙醇 ⑤乙酸 ⑥聚乙烯 ⑦苯.
| A. | ①③⑥ | B. | ③⑤⑥⑦ | C. | ①③④ | D. | ②⑤⑦ |
5.25℃时,下列各组离子在特定溶液中一定能大量共存的是( )
| A. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 在pH=0的溶液中:Na+、NO3-、SO32-、K+ | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;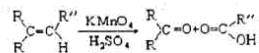

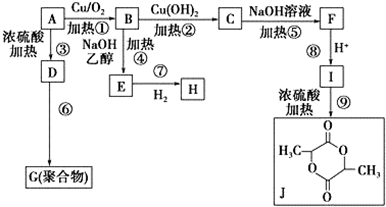
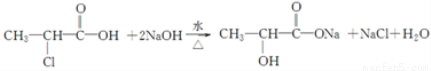 .
.