题目内容
16.下列说法正确的是( )| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | CCl4分子的比例模型为  其空间构型为正四面体 其空间构型为正四面体 | |
| C. | 全降解塑料  可由环氧丙烷 可由环氧丙烷  和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
分析 A.葡萄糖不能发生水解;
B.Cl原子半径大于C原子;
C.由结构简式可知全降解塑料(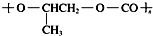 )可由单体环氧丙烷(
)可由单体环氧丙烷(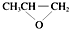 )和CO2加聚制得;
)和CO2加聚制得;
D.乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,根据氧元素质量分数计算C、H元素质量分数之和,进而计算氢元素质量分数.
解答 解:A.葡萄糖为单糖,不能发生水解,故A错误;
B.Cl原子半径大于C原子,比例模型错误,故B错误;
C.由结构简式可知全降解塑料(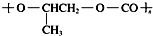 )可由单体环氧丙烷(
)可由单体环氧丙烷(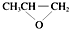 )和CO2加聚制得,不是缩聚反应,故C错误;
)和CO2加聚制得,不是缩聚反应,故C错误;
D.乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,含氧的质量分数为a,则C、H元素质量分数之和=1-a,故H元素质量分数=(1-a)×$\frac{1}{1+6}$=$\frac{1-a}{7}$,生成水的质量为14g×$\frac{1-a}{7}$×$\frac{1}{2}$×18=18(1-a)g,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握物质的性质、发生的变化、有机物组成等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列电离方程式中,正确的是( )
| A. | H2SO4═H2++SO42- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | NH4NO3═NH4++NO3- | D. | 2KClO3═2K++2Cl-+3O2- |
7.下列是某学生自己总结的一些规律,其中正确的是( )
| A. | 所有元素都有同位素 | |
| B. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| C. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| D. | 氧化物只可能是氧化产物,不可能是还原产物 |
4.在溶液中能共存,加OH-有沉淀析出,加H+能放出气体的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | AlO2-、K+、CO32-、Na+ | ||
| C. | Cl-、Al3+、NH4+、HCO3- | D. | Na+、Ca2+、Cl-、HCO3- |
11.下列说法不正确的是( )
| A. | 高压钠灯常用于道路的照明 | B. | 饱和石灰水用来制漂白粉 | ||
| C. | 硅晶体用作半导体材料 | D. | 金属镁常用来制造信号弹和焰火 |
8.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ca2+、HCO3-、NO3-、K+ |
7.近日,科学研究发现液态水或存在第二形态,当水被加热到40℃~60℃之间时,它的导热性、折射率、导电性等属性也会发生改变.下列说法正确的是( )
| A. | 氢氧两种元素只能组成H2O | |
| B. | 导热性等属于水的化学性质 | |
| C. | 0℃时冰的密度比液态水的密度小 | |
| D. | 液态水两种形态间转化需断裂O-H键 |
 烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:
烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答: