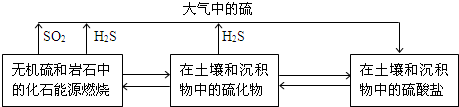
题目内容
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
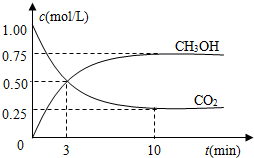
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②该反应的平衡常数表达式为K=
③下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O (g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)有人提出,可以设计反应2CO(g)=2C(s)+O2(g) 通过其自发进行来消除CO的污染.该方案
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)①根据v=
计算;
②根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)根据△G=△H-T?△S判断反应能否自发进行.
| △c |
| △t |
②根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)根据△G=△H-T?△S判断反应能否自发进行.
解答:
解:(1)①利用三段式解题法计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=
=0.225 mol?L-1?min-1,
故答案为:0.225mol?L-1?min-1;
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=
,故答案为:
;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD;
(2)反应2CO═2C+O2是吸热反应即△H>0,且△S<0,则△H-T?△S>0,反应不能自发进行,所以通过其自发进行来消除CO的污染是不可行的,
故答案为:否;△H>0,△S<0.
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| △c |
| △t |
| 2.25mol/L |
| 10min |
故答案为:0.225mol?L-1?min-1;
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD;
(2)反应2CO═2C+O2是吸热反应即△H>0,且△S<0,则△H-T?△S>0,反应不能自发进行,所以通过其自发进行来消除CO的污染是不可行的,
故答案为:否;△H>0,△S<0.
点评:本题考查较为综合,涉及化学平衡计算以及平衡移动反应自发的条件等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.

练习册系列答案
相关题目
在塑料原料加工时,添加塑化剂(DCHP)可以使其变得较为柔软,易于加工.塑化剂易溶于有机溶剂,是一种对人体有害的一类物质.塑化剂的一种制备方法如下:
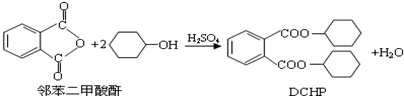
下列说法正确的是( )

下列说法正确的是( )
| A、DCHP的分子式为C20H28O4 |
| B、上述制备DCHP的反应属于取代反应 |
| C、DCHP苯环上的一氯代物有4种 |
| D、1mol DCHP最多可与含4mol NaOH的溶液反应 |
下列说法正确的( )
| A、“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
| D、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
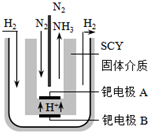 随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )| A、电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B、钯电极B连接的是电源的负极 |
| C、钯电极A的电极反应式为:N2+6e-+6H+═2NH3 |
| D、当有0.3mol电子转移时,有2.688L NH3生成 |
A、B、C均为中学常见的单质或化合物,一定条件下,存在转化关系:A+H2O→B+C.下列说法正确的是( )
| A、若B为强碱,则A一定为金属钠 |
| B、若B为强酸,则A一定为氯气 |
| C、若C为H2,则H2O一定作氧化剂 |
| D、若C为O2,则H2O一定作还原剂 |
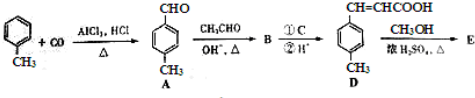
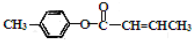 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为