题目内容
3.饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一.某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,至有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀; 第二份与稀盐酸混合,立刻产生大量气泡;第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2气体.
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因:在饱和氯水中存在:Cl2+H2O?HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,HClO的浓度增大
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份Ca2++HCO3-+OH-=CaCO3↓+H2O.
第二份Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)HClO、Ca(HCO3)2、CaCl2.
分析 (1)从Cl2+H2O HCl+HClO 平衡移动的角度分析;
HCl+HClO 平衡移动的角度分析;
(2)碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,以此书写反应的有关离子方程式;
(3)根据有关反应判断可能的产物.
解答 解:(1)在饱和氯水中存在如下平衡:Cl2+H2O?HClO+HCl,盐酸的酸性比碳酸强,而HClO的酸性比碳酸弱,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO;
故答案为:在饱和氯水中存在:Cl2+H2O?HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,HClO的浓度增大;
(2)因为碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,与石灰水混合,立即产生大量白色沉淀,反应的离子方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O,加热时碳酸氢钙分解生成CaCO3和CO2,反应的离子方程式为Ca2++2HCO3- $\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$ CaCO3↓+CO2↑+H2O;
(3)氯气与水反应Cl2+H2O?HCl+HClO,生成HClO,因为碳酸钙是过量的,并且反应中有二氧化碳生成,
因此碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙CaCO3+H2O+CO2=Ca(HCO3)2,
因此第二份与稀盐酸混合Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,
所以②的滤液中含有的溶质除了极少量的氯气外,还有HClO、Ca(HCO3)2、CaCl2,
故答案为:HClO、Ca(HCO3)2、CaCl2.
点评 本题考查律氯气的性质以及氯水的性质,题目难度中等,本题注意过量碳酸钙与氯水反应的原理,此为解答该题的关键,本题易错点为(3)过量的CaCO3与饱和氯水反应生成Ca(HCO3)2.

| A. | ${\;}_{17}^{37}$Cl表示质子数为17、中子数为20的核素 | |
| B. | 乙二醇(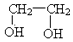 )和甘油( )和甘油(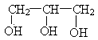 )互为同系物 )互为同系物 | |
| C. | 干冰和CO2互为同分异构体 | |
| D. | 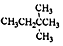 的名称是3,3-二甲基丁烷 的名称是3,3-二甲基丁烷 |
| Na2SO3 | Kal=1.54×l0-2 | Ka2=1.02×10-7 |
| HCIO | Ka1=2.95×10-8 | |
| H2CO3 | Kal=4.3×10-7 | Ka2=5.6×10-11 |
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 花生油、石油、羊油和牛油均属于高级脂肪酸甘油酯 | |
| C. | 煤在空气中经过高温强热制得焦炭、苯等化工原料 | |
| D. | 汽油、柴油通常作为汽车的燃料,是一种清洁的燃料 |
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| A. | 可能含有一个酯基和一个碳碳双键 | B. | 可能含有一个醛基和一个羰基 | ||
| C. | 可能含有一个环和一个酯基 | D. | 可能含有一个醛基和一个碳碳叁键 |
 某化学兴趣小组进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl溶液是电解质 | |
| B. | 电解质在电流的作用下才发生电离 | |
| C. | NaCl溶液中的水电离出大量的离子 | |
| D. | NaCl在水溶液中存在自由移动的离子是溶液能导电的原因 |