题目内容
(1)在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436.4KJ的能量,断裂1mol Cl-Cl键要吸收242.7KJ的能量,断裂1mol H-Cl键要吸收431.8KJ的能量,则1mol H2在Cl2中充分燃烧的能量变化是△H= .
(2)液态化合物N2H4和N2O4曾被用作火箭推进剂,燃烧反应的生成物是N2和H2O.
1mol N2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为 .
(3)已知具有相似组成和结构的分子晶体,其熔沸点随着相对分子质量的增大而升高.可是H2O的熔沸点却比H2S更高,原因是 .
(2)液态化合物N2H4和N2O4曾被用作火箭推进剂,燃烧反应的生成物是N2和H2O.
1mol N2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为
(3)已知具有相似组成和结构的分子晶体,其熔沸点随着相对分子质量的增大而升高.可是H2O的熔沸点却比H2S更高,原因是
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)根据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(3)H2O存在氢键沸点升高;
(2)根据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(3)H2O存在氢键沸点升高;
解答:
解:(1)在反应H2+Cl2
2HCl中,断裂1molH-H键,1molCl-Cl键共吸收的能量为:436.4kJ+242.7KJ=679.1kJ,生成2molHCl,共形成2molH-Cl键,放出的能量为:2×431.8KJ=863.6kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:863.6kJ-679.1kJ=184.5kJ,即△H=-184.5kJ/mol,
故答案为:-184.5kJ/mol;
(2)反应方程式为:2N2H4+N2O4=3N2+4H2O,1molN2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,所以热化学方程式为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1033.6kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1033.6kJ/mol;
(3)H2O中存在氢键,作用力更强,因此熔沸点更高;
故答案为:H2O分子之间存在氢键作用,作用力更强.
| ||
故答案为:-184.5kJ/mol;
(2)反应方程式为:2N2H4+N2O4=3N2+4H2O,1molN2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,所以热化学方程式为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1033.6kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1033.6kJ/mol;
(3)H2O中存在氢键,作用力更强,因此熔沸点更高;
故答案为:H2O分子之间存在氢键作用,作用力更强.
点评:本题主要考查了热化学方程式式的书写,反应热的计算以及氢键等知识,难度不大,注意基础知识的掌握.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列物质中属于晶体的是( )
| A、玻璃 | B、水晶 | C、水泥 | D、橡胶 |
 实验室需用230mL 0.1mol/L的Na2CO3溶液,填空并回答下列问题:
实验室需用230mL 0.1mol/L的Na2CO3溶液,填空并回答下列问题: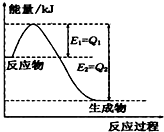 (1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:
(1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为: (1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)
(1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)
 ⑤O2与O3
⑤O2与O3