��Ŀ����
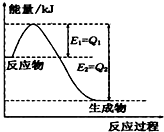 ��1��һ�������£�N2��H2��Ӧ����lmolNH3�����������仯����ͼ��ʾ����1mol N2��ȫ��Ӧʱ���ʱ�Ϊ��
��1��һ�������£�N2��H2��Ӧ����lmolNH3�����������仯����ͼ��ʾ����1mol N2��ȫ��Ӧʱ���ʱ�Ϊ����2��25�棬��a mol?L-1��ˮ��b mol?L-1����������ϣ�ʹ��Һ�����ԣ���c��NH4+��
�ú�a��b�Ĵ���ʽ��ʾ�û����Һ�а�ˮ�ĵ���ƽ�ⳣ�� K=
��3��25�棬��0.1L0.002mol?L-l��NaCl��Һ����μ���0.1L0.002mol?L-l AgNO3��Һ���а�ɫ�������ɣ����ܶȻ��ĽǶȽ��Ͳ���������ԭ��
����֪��25��ʱKSP��AgCl��=1.6��l0-10 KSP��AgI��=1.5��l0-16��
���㣺��Ӧ�Ⱥ��ʱ�,���������ˮ��Һ�еĵ���ƽ��,���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���
ר�⣺�����������������
��������1����ͼ���N2��H2��Ӧ����1molNH3�ķ�Ӧ�ȣ��ٸ����Ȼ�ѧ��Ӧ����ʽ����д���
��2����a mol?L-1�İ�ˮ��b mol?L-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L������k=
���㣻
��3������Qc��Ksp����Դ�С��ȷ����û�г����������ܽ��ԽСԽ���γɳ�����
��2����a mol?L-1�İ�ˮ��b mol?L-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L������k=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
��3������Qc��Ksp����Դ�С��ȷ����û�г����������ܽ��ԽСԽ���γɳ�����
���
�⣺��1����ͼ��֪��N2��H2��Ӧ����1molNH3�ų�������Ϊ��Q1-Q2��kJ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪN2��g��+3H2��g��?2NH3��g����H=-2��Q1-Q2��kJ?mol-1��
�ʴ�Ϊ��2��Q1-Q2�� kJ?mol-1��
��2����a mol?L-1�İ�ˮ��b mol?L-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L��
��Һ��c��NH4+��=c��Cl-��=
mol/L����Ϻ�Ӧǰc��NH3?H2O��=
mol/L����Ӧ��c��NH3?H2O��=��
-
��mol/L��
��k=
=
=
��
�ʴ�Ϊ��=��
��
��3��Qc=c��Ag+����c��Cl-��=0.001mol?L-l��0.001mol?L-l=10-6��Ksp��AgCl���������г�����KSP��AgCl����KSP��AgI������ת��������AgCl��ת��ΪAgI����ɫ����ת��Ϊ��ɫ���������ӷ�ӦΪAgCl��s��+I-��aq��=AgI��s��+Cl-��aq����
�ʴ�Ϊ��c��Ag+����c��Cl-����Ksp��AgCl������ɫ����ת��Ϊ��ɫ������AgCl��s��+I-��aq��=AgI��s��+Cl-��aq����
�ʴ�Ϊ��2��Q1-Q2�� kJ?mol-1��
��2����a mol?L-1�İ�ˮ��b mol?L-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L��
��Һ��c��NH4+��=c��Cl-��=
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
��k=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| ||||
|
| b��10-7 |
| a-b |
�ʴ�Ϊ��=��
| b��10-7 |
| a-b |
��3��Qc=c��Ag+����c��Cl-��=0.001mol?L-l��0.001mol?L-l=10-6��Ksp��AgCl���������г�����KSP��AgCl����KSP��AgI������ת��������AgCl��ת��ΪAgI����ɫ����ת��Ϊ��ɫ���������ӷ�ӦΪAgCl��s��+I-��aq��=AgI��s��+Cl-��aq����
�ʴ�Ϊ��c��Ag+����c��Cl-����Ksp��AgCl������ɫ����ת��Ϊ��ɫ������AgCl��s��+I-��aq��=AgI��s��+Cl-��aq����
���������⿼�����Ȼ�ѧ����ʽ��д��������ʵ���ƽ��ļ���Ӧ�ã������ܽ�ƽ��ķ����жϣ���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д� Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д�
�����Ŀ
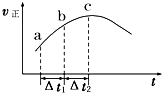 ����Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ���淴ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó���ȷ�Ľ����ǣ�������
����Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ���淴ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó���ȷ�Ľ����ǣ�������| A����Ӧ�� c ��ﵽƽ��״̬ |
| B����Ӧ��Ũ�ȣ�a ��С�� b �� |
| C����Ӧ�������������������������� |
| D����t1=��t2 ʱ��SO2 ��ת���ʣ�a��b ��С�� b��c �� |
 ��ͼ����̵�صķ�Ӧԭ��ʾ��ͼ�����е����KClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У��õ�LiMnO2���ش��������⣺
��ͼ����̵�صķ�Ӧԭ��ʾ��ͼ�����е����KClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У��õ�LiMnO2���ش��������⣺
