题目内容
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
②据表推测O3在下列条件下分解速率依次增大的顺序为
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
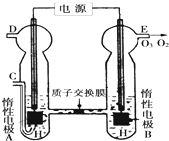
(2)O3可由臭氧发生器(原理如下图)电解稀硫酸制得.
①图中阴极为
②若C处通入O2,A极的电极反应式为
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为
考点:化学反应速率的影响因素,电解原理
专题:化学反应速率专题,电化学专题
分析:(1)①根据v=
计算;
②根据pH和温度判断达到平衡所用的时间的范围,可判断分解速率;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②C处通入O2,O2发生还原反应,在酸性条件下生成水;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为yL,令臭氧的体积为ZL,利用电子转移守恒列放出计算Z的值,再根据体积分数定义计算.
| △c |
| t |
②根据pH和温度判断达到平衡所用的时间的范围,可判断分解速率;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②C处通入O2,O2发生还原反应,在酸性条件下生成水;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为yL,令臭氧的体积为ZL,利用电子转移守恒列放出计算Z的值,再根据体积分数定义计算.
解答:
解:(1)①v=
=
=1.00×10-4mol/(L?min),故答案为:1.00×10-4;
②由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231nin;
30°C、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c,
故答案为:b、a、c;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑;
故答案为:A;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为y L,令臭氧的体积为ZL,根据电子转移守恒有
x×2=Z×3×2+(y-Z)×2×2,解得Z=x-2y,所以E处收集的气体中O3所占的体积分数为
,
故答案为:
.
| △c |
| t |
| 0.0108mol/L |
| 108min |
②由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231nin;
30°C、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c,
故答案为:b、a、c;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑;
故答案为:A;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为y L,令臭氧的体积为ZL,根据电子转移守恒有
x×2=Z×3×2+(y-Z)×2×2,解得Z=x-2y,所以E处收集的气体中O3所占的体积分数为
| x-2y |
| y |
故答案为:
| x-2y |
| y |
点评:本题考查化学反应速率的影响因素的实验探究,原电池与电解池反应原理,侧重于学生的分析能力和计算能力的考查,题目难度中等,本题注意对表中数据的分析和处理.

练习册系列答案
相关题目
下列反应属于加成反应的是( )
| A、乙烯与氧气的反应 |
| B、乙烯使酸性高锰酸钾溶液褪色的反应 |
| C、甲烷与氯气在光照下的反应 |
| D、乙烯在催化剂作用下与水反应 |
化学式为C5H10O2的物质中,能与Na2CO3反应的放出气体的物质的结构共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
 实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:
实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL: 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.