题目内容
5.在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g)?3C(g)+D(g),平衡时C的浓度为amol•L-1.若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol•L-1的是( )| A. | 4molA+2molB | B. | 3molC+1molB+1molD+1molA | ||
| C. | 2molA+1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
分析 恒温恒容下,不同途径达到平衡后,C的浓度仍为a mol/L,说明与原平衡为等效平衡,按化学计量数转化到左边,满足n(A)=2mol,n(B)=1mol即可,据此解答.
解答 解:A、开始加入4molA+2molB,相当于在加入2molA和1molB达平衡后,再加入2molA和1molB,平衡向正反应进行,平衡时C的浓度大于amol/L,但转化率降低,故C的浓度小于2amol/L,故A错误;
B、开始加入3molC+1molB+1molD+1molA,将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入3molA+2molB所到达的平衡,则平衡时C的浓度不等于amol/L,故B错误;
C、开始加入2molA+1molB+1molD,等效为在加入2molA和1molB达平衡后,再加入1molD,平衡向逆反应进行,平衡时C的浓度小于amol/L,故C错误;
D、开始加入1molA+0.5molB+1.5molC+0.5molD,将1.5molC+0.5molD按化学计量数转化到左边可得1molA、0.5molB,故等效为开始加入2molA+1molB所到达的平衡,与原平衡为等效平衡,故D正确;
故选D.
点评 考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.浓度为0.1mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
| A. | 0.5mol/L | B. | 0.01mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
13.为了增加汽车轮胎的耐磨性,常在轮胎的橡胶中加入的耐磨物质是( )
| A. | 黏土 | B. | 硫磺粉 | C. | 炭黑 | D. | 草木灰 |
20.在水溶液中,下列电离方程式中,书写正确的是( )
| A. | H2CO3?2H++CO32- | B. | NaHSO4?Na++HSO4- | ||
| C. | H2S+H2O?HS-+H3O+ | D. | Ca(OH)2?Ca2++2OH- |
17.下列表格中各项都正确的一组是( )
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 明矾 | 食盐 | 石墨 | 醋酸 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| D | KOH | CuSO4 | Na2SO4 | NaClO |
| A. | A | B. | B | C. | C | D. | D |
12. 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①反应达到平衡后,再通入一定量的氩气,则CO的转化率将不变(填“增大”、“减小”、“不变”);
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
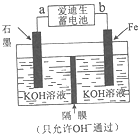
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.
 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.