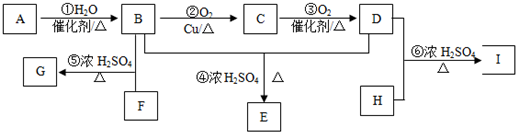
题目内容
 Ⅰ.25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:
Ⅰ.25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:(1)A点各离子浓度大小关系为
(2)取20ml这种Ba(OH)2溶液加水稀释到200ml,
所得溶液中由水电离出的氢离子浓度为
(3)若C点pH=3,则C(CH3COOH)+C(H+)=
(4)取一定体积的Ba(OH)2溶液,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+沉淀完全的时候,pH=12,则Ba(OH)2溶液和NaHSO4溶液的体积比为
Ⅱ.取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应.甲加入50mLpH=2盐酸,乙加入50mL pH=2醋酸,丙加入50mL pH=2醋酸及少量的胆矾粉末.
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌.回答以下问题.
①三支试管中参加反应的锌的质量大小关系为:
②反应终了,所需时间为:
③若以上三组实验,锌粉均过量,产生的氢气体积
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:Ⅰ.(1)在A点醋酸和Ba(OH)2恰好中和生成Ba(Ac)2,为强碱弱酸盐,水解呈碱性,但Ac-水解程度较小;
(2)由图象可知,开始时,C(OH-)=0.1mol/L,碱溶液中水电离出氢离子浓度等于=
;
(3)在C点醋酸刚好有一半过量,根据物料守恒、电荷守恒判断;
(4)氢氧化钡和硫酸氢钠反应,当溶液中Ba2+沉淀完全的时候,Ba(OH)2和NaHSO4按照物质的量1:1反应,结合溶液的pH和溶液体积换算物质的量列式计算.
Ⅱ.(1)pH相等的盐酸和醋酸,醋酸的物质的量浓度大于盐酸,则等体积和等pH的盐酸和醋酸,盐酸的物质的量小于醋酸,生成氢气的体积相同,则消耗酸的物质的量相同,根据剩余的酸确定加入锌的质量;
(2)①根据锌参加的反应确定锌的质量大小;
②构成原电池的反应速率大于没有构成原电池的反应速率,没有构成原电池的反应中,氢离子浓度越大,反应速率越大;
③根据酸的物质的量确定生成氢气的体积大小.
(2)由图象可知,开始时,C(OH-)=0.1mol/L,碱溶液中水电离出氢离子浓度等于=
| Kw |
| c(OH-) |
(3)在C点醋酸刚好有一半过量,根据物料守恒、电荷守恒判断;
(4)氢氧化钡和硫酸氢钠反应,当溶液中Ba2+沉淀完全的时候,Ba(OH)2和NaHSO4按照物质的量1:1反应,结合溶液的pH和溶液体积换算物质的量列式计算.
Ⅱ.(1)pH相等的盐酸和醋酸,醋酸的物质的量浓度大于盐酸,则等体积和等pH的盐酸和醋酸,盐酸的物质的量小于醋酸,生成氢气的体积相同,则消耗酸的物质的量相同,根据剩余的酸确定加入锌的质量;
(2)①根据锌参加的反应确定锌的质量大小;
②构成原电池的反应速率大于没有构成原电池的反应速率,没有构成原电池的反应中,氢离子浓度越大,反应速率越大;
③根据酸的物质的量确定生成氢气的体积大小.
解答:
解:Ⅰ.(1)在A点醋酸和NaOH恰好中和生成NaAc,为强碱弱酸盐,水解呈碱性,但Ac-水解程度较小,离子浓度大小关系为:C(CH3COO_)>C(Ba2+)>c(OH-)>c(H+);
(2)由图象可知,开始时,C(OH-)=0.1mol/L,取20ml这种Ba(OH)2溶液加水稀释到200ml,溶液中氢氧根离子浓度=0.01mol/L,所得溶液中由水电离出的氢离子浓度为
mol/L=10-12mol/L,故答案为:10-12mol/L;
(3)若C点pH=3,则c(H+)=1×10-3mol/L,c(OH-)=1×10-11mol/L,C点时,n(Ba(OH)2)=0.002mol,加入n(CH3COOH)=0.004mol,n(Ba(OH)2)=0.001mol,CH3COOH以CH3COO-和CH3COOH两种形式存在,而Ba全以Ba2+形式存在,溶液中c(CH3COO-)+c(CH3COOH)=4c(Ba2+),c(Ba2+)=0.025mol/L,由电荷守恒2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-)和物料守恒c(CH3COO-)+c(CH3COOH)=4c(Ba2+),则c(CH3COOH)+c(H+)=2c(Ba2+)+c(OH-);
故答案为:2c(Ba2+)+c(OH-);
(4)pH=13的Ba(OH)2溶液中C(OH-)=10-1mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-1mol;反应的硫酸氢钠物质的量为0.5x×10-1mol;设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;
所以得到:
=10-3;
得到x:y=1:9,
故答案为:1:9;
Ⅱ.(1)pH相等的盐酸和醋酸中,C(CH3COOH)>C(HCl),则等体积和等pH的盐酸和醋酸,n(CH3COOH)>n(HCl),生成氢气的体积相同,则消耗酸的物质的量相同,所以醋酸过量,则醋酸溶液中锌不足,而盐酸溶液中锌有剩余,故甲>乙,
故答案为:甲>乙;
(2)①若反应终了生成氢气的体积一样多,且没有剩余的锌,则甲、乙、丙中与酸反应的锌的质量相同,但丙中锌还和铜离子发生置换反应,所以丙中消耗锌最多,而甲和乙中消耗锌的质量相同;
故答案为:丙>甲=乙;
②丙中锌置换出铜,铜、锌和酸构成原电池而加快反应速率,反应过程中,乙中氢离子浓度大于甲,所以乙中反应速率大于甲,反应终了,所需时间为:甲>乙>丙;
故答案为:甲>乙>丙;
③乙和丙中醋酸的物质的量相同,甲中酸的物质的量小于丙和乙,且盐酸和醋酸都是一元酸,所以若以上三组实验,锌粉均过量,产生的氢气体积乙=丙>甲;
故答案为:乙=丙>甲.
(2)由图象可知,开始时,C(OH-)=0.1mol/L,取20ml这种Ba(OH)2溶液加水稀释到200ml,溶液中氢氧根离子浓度=0.01mol/L,所得溶液中由水电离出的氢离子浓度为
| 1×10-14 |
| 0.01 |
(3)若C点pH=3,则c(H+)=1×10-3mol/L,c(OH-)=1×10-11mol/L,C点时,n(Ba(OH)2)=0.002mol,加入n(CH3COOH)=0.004mol,n(Ba(OH)2)=0.001mol,CH3COOH以CH3COO-和CH3COOH两种形式存在,而Ba全以Ba2+形式存在,溶液中c(CH3COO-)+c(CH3COOH)=4c(Ba2+),c(Ba2+)=0.025mol/L,由电荷守恒2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-)和物料守恒c(CH3COO-)+c(CH3COOH)=4c(Ba2+),则c(CH3COOH)+c(H+)=2c(Ba2+)+c(OH-);
故答案为:2c(Ba2+)+c(OH-);
(4)pH=13的Ba(OH)2溶液中C(OH-)=10-1mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-1mol;反应的硫酸氢钠物质的量为0.5x×10-1mol;设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;
所以得到:
| x×10-1-0.5x×10-1 |
| x+y |
得到x:y=1:9,
故答案为:1:9;
Ⅱ.(1)pH相等的盐酸和醋酸中,C(CH3COOH)>C(HCl),则等体积和等pH的盐酸和醋酸,n(CH3COOH)>n(HCl),生成氢气的体积相同,则消耗酸的物质的量相同,所以醋酸过量,则醋酸溶液中锌不足,而盐酸溶液中锌有剩余,故甲>乙,
故答案为:甲>乙;
(2)①若反应终了生成氢气的体积一样多,且没有剩余的锌,则甲、乙、丙中与酸反应的锌的质量相同,但丙中锌还和铜离子发生置换反应,所以丙中消耗锌最多,而甲和乙中消耗锌的质量相同;
故答案为:丙>甲=乙;
②丙中锌置换出铜,铜、锌和酸构成原电池而加快反应速率,反应过程中,乙中氢离子浓度大于甲,所以乙中反应速率大于甲,反应终了,所需时间为:甲>乙>丙;
故答案为:甲>乙>丙;
③乙和丙中醋酸的物质的量相同,甲中酸的物质的量小于丙和乙,且盐酸和醋酸都是一元酸,所以若以上三组实验,锌粉均过量,产生的氢气体积乙=丙>甲;
故答案为:乙=丙>甲.
点评:本题考查了酸、碱反应的综合计算,弱电解质的电离,溶液pH的计算,注意溶液中氢氧根离子浓度和溶质浓度的关系是解题关键以及能构成原电池的金属能加快反应速率,为易错点.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
下列实验操作中错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中(放有等质量的纸) |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1L 0.1mol/L(NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+) |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、常温下,CH3COONa溶液和盐酸混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、25℃时,pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(C2O42-)>c(H2C2O4) |