题目内容
8.0.5mol SO2,所含有的分子数约为3.01×1023个,质量为32g. 等质量的O2和O3所含的原子个数之比是1:1. 标准状况下,2mol NH3与88g CO2的体积相等.分析 结合N=nNA、m=nM及分子构成计算.
解答 解:0.5mol SO2,所含有的分子数约为0.5mol×NA=3.01×1023 个,质量为0.5mol×64g/mol=32g. 等质量的O2和O3所含的原子个数之比是$\frac{m}{32}×2$:$\frac{m}{48}×3$=1:1,标准状况下,2mol NH3与2mol×44g/mol=88g CO2的体积相等,
故答案为:3.01×1023;32g;1:1; 88.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、微粒数的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列化学反应的离子方程式正确的是( )
| A. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-═CaCO3↓+H2O |
16.下列物质属于纯净物的是( )
| A. | 洁净的空气 | B. | 食盐水 | C. | Na2SO4•10H2O | D. | 糖水 |
3.在反应3Cl2+2FeBr2═2FeCl3+2Br2中被还原的元素是( )
| A. | Fe | B. | Fe和Cl | C. | Cl | D. | Br |
13.下列有关物质的性质或应用的说法正确的是( )
| A. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
20.实验室制Cl2的反应为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.下列说法错误的( )
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1 mol HCl,转移电子的物质的量为2 mol | |
| C. | 每生成1 mol Cl2,转移电子的物质的量为2 mol | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
17.天然存在的金属钫(Fr)极微量,它的21个已知同位素都有放射性,它是碱金属元素中最重的元素.根据它在周期表中的位置语言其性质,其中不正确的是( )
| A. | 在已知元素中具有最大的原子半径 | B. | 其单质的熔点比金属钠的熔点高 | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 金属钫与氧气或水反应非常剧烈 |
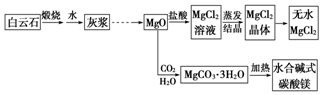 碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:
碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题: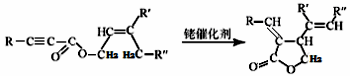 (R、R‘、R“表示氢、烷基或芳基)
(R、R‘、R“表示氢、烷基或芳基)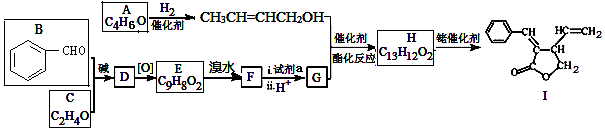
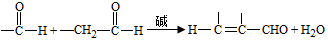
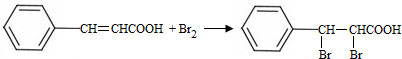 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.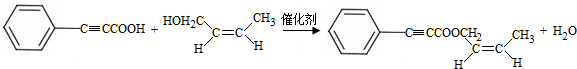 .
.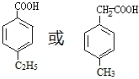 (写出一种即可).
(写出一种即可).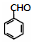 和CH3CHO为原料合成
和CH3CHO为原料合成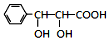 的合成路线流程图:
的合成路线流程图: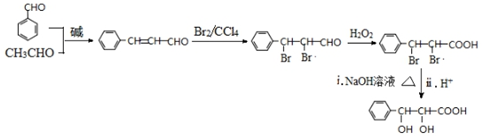 .(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
.(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$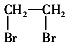 )
)