题目内容
14.工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)制取铝的过程如图:
(1)试剂1为NaOH溶液,①~④转化过程中④消耗能量最多.
(2)转化①中加入试剂1时发生反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O
(3)转化②中通入过量CO2后生成沉淀的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
(4)生产过程中,除物质E可以循环利用外,还可以循环使用的物质有CaO、CO2.
分析 A可与二氧化碳反应生成沉淀,则A应为NaAlO2和Na2SiO3,可知试剂①为NaOH溶液,沉淀B为Fe2O3,沉淀D为Al(OH)3和H2SiO3,滤液C为NaAlO2和Na2SiO3,溶液C为碳酸氢钠溶液,加入CaO,反应生成NaOH和CaCO3沉淀,E为NaOH,可循环使用,F为Al2O3和SiO2,电解可生成Al,以此解答该题.
解答 解:A可与二氧化碳反应生成沉淀,则A应为NaAlO2,可知试剂①为NaOH溶液,沉淀B为Fe2O3,沉淀D为Al(OH)3和H2SiO3,滤液C为NaAlO2和Na2SiO3,溶液C为碳酸氢钠溶液,加入CaO,反应生成NaOH和CaCO3沉淀,E为NaOH,可循环使用,F为Al2O3和SiO2,电解可生成Al,
(1)由以上分析可知①为NaOH溶液,反应①②③在溶液中进行,不消耗能量,而④为电解熔融的氧化铝,消耗热能和电能,则消耗能量最多,
故答案为:NaOH溶液;④;
(2)转化①Al2O3、SiO2与NaOH反应,而Fe2O3不与NaOH反应,反应的化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O,
故答案为:Al2O3+2NaOH═2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O;
(3)A为NaAlO2和Na2SiO3,通入二氧化碳反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(4)流程中用到二氧化碳和氧化钙,而碳酸钙在加热时可分解生成,可循环使用,故答案为:CaO、CO2.
点评 本题考查混合物分离提纯方法的综合应用,为高频考点,把握流程中的反应及化学反应方程式书写为解答的关键,侧重分析、实验能力及化学用语的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 阳离子不一定是金属离子,含阳离子的物质一定含阴离子 | |
| B. | 阴、阳离子相互反应不一定形成离子化合物 | |
| C. | 共价化合物均属于弱电解质 | |
| D. | 由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 |
| A. | 升高温度,正反应速率增大,化学平衡常数增大 | |
| B. | 减小压强,逆反应速率减小,化学平衡常数减小 | |
| C. | 加入催化剂,正逆反应速率不变,平衡不移动 | |
| D. | 充入氧气,正反应速率先增大后减小,平衡向正反应方向移动 |
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
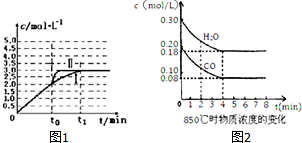
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是C(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应平衡常数会减小
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(4)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(3)中平衡时相同,则a=3mol,b=3mol.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了实验设计表中.
表中剩余的实验条件数据:
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
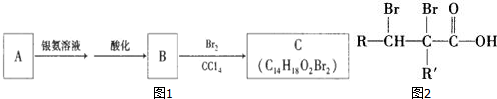
| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 12 种 | B. | 24 种 | C. | 36 种 | D. | 40 种 |
| A. | CuO | B. | NaCl | C. | SiO2 | D. |  |
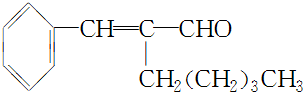 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$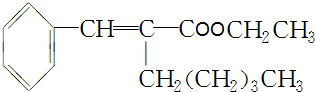 +H2O.
+H2O.