题目内容
10.下列装置所示的实验中,能达到实验目的是( )| A. |  分离碘酒中的碘和酒精 | B. |  实验室制氨气 | ||
| C. |  排水集气法收集NO | D. |  除去Cl2中的HCl |
分析 A.碘和酒精互溶;
B.氯化铵分解后,在试管口又化合生成氯化铵;
C.NO不溶于水;
D.二者均与NaOH反应.
解答 解:A.碘和酒精互溶,不能利用图中分液装置分离,应选蒸馏法,故A错误;
B.氯化铵分解后,在试管口又化合生成氯化铵,不能制备氨气,应选铵盐与碱共热制备,故B错误;
C.NO不溶于水,则图中导管短进长出可排出水收集NO,故C正确;
D.二者均与NaOH反应,不能除杂,应选饱和食盐水,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、混合物分离提纯、气体的制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意实验的评价性分析.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量,该反应为吸热反应 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)=2H2O(g)△H1,②2H2(g)+O2 (g)=2H2O(1)△H2,则△H1<△H2 | |
| D. | 已知:①C(s,石墨)+O2 (g)=CO2(g)△H=-393.5kJ•mol-1, ②C(s,金刚石)+O2(g)=CO2 (g)△H=-395.0 kJ•mol-1则C(s,石墨)=C(s,金刚石)△H=+1.5 kJ•mol-1 |
18.心理学研究发现一个人心理平衡才能把化学平衡的题做好.已知COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施:
①升温
②恒容通入惰性气体
③增加CO的浓度
④扩大容积
⑤加催化剂
⑥恒压通入惰性气体,
能提高COCl2转化率的是( )
①升温
②恒容通入惰性气体
③增加CO的浓度
④扩大容积
⑤加催化剂
⑥恒压通入惰性气体,
能提高COCl2转化率的是( )
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
5.观察下列有关实验装置,相关评价错误的是( )
| A. | 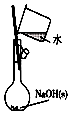 用于配制0.10 mol•L-1 NaOH溶液;评价:正确 | |
| B. |  用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒 | |
| C. | 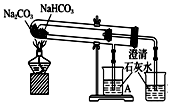 用于比较Na2CO3、NaHCO3的热稳定性;评价:正确 | |
| D. | 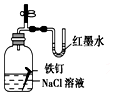 证明铁发生吸氧腐蚀时空气参加反应;评价:正确 |
15.下列关于配位化合物的叙述中,不正确的是( )
| A. | 配位化合物中必定存在配位键 | |
| B. | 配位化合物中只有配位键 | |
| C. | 〔Fe(SCN)6〕3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键 | |
| D. | 许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如N3、H+等)都能形成配合物 |
2.醋酸的下列性质中,可以证明它是弱电解质的是( )
①白醋中滴入石蕊试液呈红色
②室温时,0.1mol/L醋酸溶液的pH约为3
③10mL 1mol/L醋酸恰好与10mL 1mol/L NaOH溶液完全反应
④常温下,测得醋酸钠溶液的pH>7
⑤醋酸溶液的导电性比强酸溶液的弱
⑥常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4.
①白醋中滴入石蕊试液呈红色
②室温时,0.1mol/L醋酸溶液的pH约为3
③10mL 1mol/L醋酸恰好与10mL 1mol/L NaOH溶液完全反应
④常温下,测得醋酸钠溶液的pH>7
⑤醋酸溶液的导电性比强酸溶液的弱
⑥常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4.
| A. | ②④⑤⑥ | B. | ①②④ | C. | ②④⑥ | D. | ②⑥ |
19.由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
| 装置 | 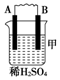 |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
20.已知H2CO3的Ka1=4.2×l0-7.室温下,H2SeO4存在以下电离过程:H2SeO4=H++HSeO4-;HSeO4-?H++SeO42-,K=1.2×10-2.下列相关叙述正确的是( )
| A. | NaHSeO4溶液和Na2SeO4溶液均显碱性 | |
| B. | pH=3的H2SeO4和NaHSeO4溶液,后者水的电离程度大 | |
| C. | H2SeO4溶液中滴加少量氨水的离子方程式:H++NH3•H2O=NH4++H2O | |
| D. | Na2CO3溶液中加入少量H2SeO4的离子方程式为:CO32-+H+=HCO3- |