题目内容
1.下列说法正确的是( )| A. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量,该反应为吸热反应 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)=2H2O(g)△H1,②2H2(g)+O2 (g)=2H2O(1)△H2,则△H1<△H2 | |
| D. | 已知:①C(s,石墨)+O2 (g)=CO2(g)△H=-393.5kJ•mol-1, ②C(s,金刚石)+O2(g)=CO2 (g)△H=-395.0 kJ•mol-1则C(s,石墨)=C(s,金刚石)△H=+1.5 kJ•mol-1 |
分析 A.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量,说明生成物键能大于反应物键能;
B.弱酸、弱碱电离吸收能量;
C.氢气的燃烧为放热反应,液态水变为气态水吸收能量;
D.根据盖斯定律将①-②可得C(s,石墨)=C(s,金刚石)△H=+1.5 kJ•mol-1.
解答 解:A.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量,说明生成物键能大于反应物键能,化学反应中断裂化学键吸收能量,形成化学键释放能量,则破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量,该反应为放热反应,故A错误;
B.弱酸、弱碱电离吸收能量,与强酸、强碱的反应相比较,放出的能量少,故B错误;
C.氢气的燃烧为放热反应,H<0,液态水变为气态水吸收能量,则生成液态水放出的能量多,则△H1>△H2,故C错误;
D.根据盖斯定律将①-②可得C(s,石墨)=C(s,金刚石)△H=+1.5 kJ•mol-1,故D正确.
故选D.
点评 本题综合考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,注意把握相关概念的理解,难度不大.

练习册系列答案
相关题目
16.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 组别 物质 | 甲 | 乙 | 丙 |
| A | Al2O3 | H2SO4 | NaOH |
| B | NO2 | HNO3 | NH3 |
| C | SiO2 | HF | NaOH |
| D | SO2 | Ca(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
9.纯锌和稀硫酸反应速率很小,为了加快锌的溶解和放出H2的速率,可以加入少量( )
| A. | 硫酸铜晶体 | B. | 稀盐酸 | C. | 镁带 | D. | 碘化钾溶液 |
16.下列说法中正确的是( )
| A. | 离子键是阴阳离子间存在的静电引力 | |
| B. | 失电子难的原子获得电子的能力一定强 | |
| C. | 在化学反应中,某元素由化合态变为游离态,该元素被还原 | |
| D. | 电子层结构相同的不同离子,其半径随核电荷数增多而减小 |
6.某澄清溶液可能由KI、NaNO3、CaCl2和Na2CO3中的一种或几种混合而成,为鉴定其组成,依次进行如下实验;(1)上述溶液中滴加AgNO3溶液有浅黄色沉淀产生;(2)将沉淀滤出加HNO3时,沉淀部分溶解,有气体放出;(3)向一份溶液中加淀粉溶液,再加适量氯水,溶液显蓝色.根据以上实验可判断( )
| A. | 一定有CaCl2和Na2CO3,一定没有KI,可能有NaNO3 | |
| B. | 一定有KI、Na2CO3,可能有NaNO3、CaCl2 | |
| C. | 一定有KI、Na2CO3,可能有NaNO3,一定没有CaCl2 | |
| D. | 只有Na2CO3,可能有NaNO3,一定没有KI、CaCl2 |
13.下列有关化学用语表示正确的是( )
| A. | K+的结构示意图: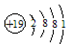 | |
| B. | B、基态氮原子的电子排布图 | |
| C. | 水的电子式: | |
| D. | D、基态铬原子(24Cr)的价电子排布式:3d44s2 |
10.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中的碘和酒精 | B. |  实验室制氨气 | ||
| C. |  排水集气法收集NO | D. |  除去Cl2中的HCl |
