题目内容
1.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:2NO(g)?N2(g)+O2(g) K1=1×10302H2(g)+O2(g)?2H2O(l) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92以下说法正确的是( )
| A. | 常温下,NO分解产生O2的反应平衡常数表达式为K1=[N2][O2] | |
| B. | 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | |
| C. | 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | |
| D. | 以上说法都不正确 |
分析 A.化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值;
B.根据方程式的书写反写,平衡常数是原来的倒数;
C.根据化学平衡常数K的数值越大,化学反应进行的程度越大;
D.根据ABC选项的情况回答.
解答 解:A.常温下,NO分解产生O2的反应的平衡常数表达式式K1=$\frac{c(N{\;}_{2})•c(O{\;}_{2})}{c{\;}^{2}(NO)}$,故A错误;
B.2H2(g)+O2(g)?2H2O(g) K2=2×1081,所以2H2O(g)?2H2(g)+O2(g) K=$\frac{1}{2×10{\;}^{81}}$=5×10-82,故B错误;
C.由2H2O(g)?2H2(g)+O2(g) K=5×10-82,则常温下,NO、H2O、CO2三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>H2O>CO2,故C正确;
D.因C正确,故D错误;
故选:C.
点评 本题考查的是化学平衡常数的相关知识,化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{-5}}{\frac{0.1}{2.2}×1.01×1{0}^{-5}×(\frac{0.3}{2.2}×1.01×1{0}^{-5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)如表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
①X、Y、C三种气体发生反应的化学方程式为Y+3X?2C.
②表中a的取值范围是25.1<a<64.2.
③根据如图3和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强;50min~65min内曲线发生变化的原因可能是增加C的物质的量或增大C的浓度.
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{-5}}{\frac{0.1}{2.2}×1.01×1{0}^{-5}×(\frac{0.3}{2.2}×1.01×1{0}^{-5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)如表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
| 压强/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据如图3和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强;50min~65min内曲线发生变化的原因可能是增加C的物质的量或增大C的浓度.
11.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见表(kJ/mol):
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
(2)X、Y、Z三种元素所形成的常见化合物的名称为碳酸钠;XY2的结构式为O=C=O,分子立体构型为直线形.
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是金刚石(填名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体,CCl4为分子晶体,离子晶体熔点比分子晶体高.
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见表(kJ/mol):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)Z2Y2的电子式为
 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.(2)X、Y、Z三种元素所形成的常见化合物的名称为碳酸钠;XY2的结构式为O=C=O,分子立体构型为直线形.
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是金刚石(填名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体,CCl4为分子晶体,离子晶体熔点比分子晶体高.
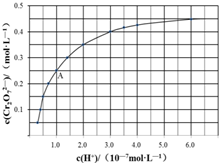 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: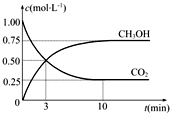 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:


