题目内容
下列六种物质中,不能与CO2反应的是( )
①Na2O ②Na2O2 ③CaCl2溶液 ④Na2CO3溶液 ⑤NaOH溶液 ⑥NaHCO3溶液.
①Na2O ②Na2O2 ③CaCl2溶液 ④Na2CO3溶液 ⑤NaOH溶液 ⑥NaHCO3溶液.
| A、③⑥ | B、③④ | C、②③ | D、②⑤ |
考点:钠的重要化合物
专题:几种重要的金属及其化合物
分析:二氧化碳是酸性氧化物,利用选项中的各物质的化学性质和二氧化碳的化学性质进行分析判断.
解答:
解:①Na2O能和二氧化碳反应:Na2O+CO2=Na2CO3,故错误;
②Na2O2能和二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2,故错误;
③CaCl2溶液不能和二氧化碳反应,故正确;
④Na2CO3溶液能和二氧化碳反应:Na2CO3+CO2+H2O=2NaHCO3,故错误;
⑤NaOH溶液能和二氧化碳反应:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2=NaHCO3,故错误;
⑥NaHCO3溶液不能和二氧化碳反应,故正确;
故选A.
②Na2O2能和二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2,故错误;
③CaCl2溶液不能和二氧化碳反应,故正确;
④Na2CO3溶液能和二氧化碳反应:Na2CO3+CO2+H2O=2NaHCO3,故错误;
⑤NaOH溶液能和二氧化碳反应:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2=NaHCO3,故错误;
⑥NaHCO3溶液不能和二氧化碳反应,故正确;
故选A.
点评:本题考查了二氧化碳的化学性质,掌握酸性氧化物的性质、强酸制取弱酸的反应原理是解题的关键.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
已知热化学方程式:SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ?mol-1,现有4molSO2参加反应,当放出314.3kJ热量时,约剩余SO2的物质的量为( )
| 1 |
| 2 |
| A、1.4mol |
| B、2.6mol |
| C、0.8mol |
| D、1mol |
下列各组离子在所给条件下能够大量共存的是( )
| A、pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-13mol?L-1的溶液中,K+、HCO3-、Cl-、S2- |
| C、使pH试纸显深蓝色的溶液中,Cu2+、NO3-、Fe3+、SO42- |
| D、在AlCl3溶液中,Na+、AlO2-、NO3-、SO42- |
下列排列顺序正确的是( )
| A、常温下将0.1 mol?L-1 CH3COONa溶液与0.05 mol?L-1 HCl溶液等体积混合,c (Na+)>c (Cl-)>c(CH3COO-)>c (OH-)>c (H+) |
| B、常温下物质的量浓度相等的①NH4HSO4;②(NH4 )2CO3;③NH4Cl三种溶液中c(NH4+):①>③>② |
| C、常温下0.1mol?L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A) |
D、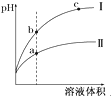 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ |
要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验( )
| A、Cu、FeCl2溶液、MgCl2溶液 |
| B、Fe、Cu、MgCl2溶液 |
| C、Mg、CuO、FeSO4溶液 |
| D、Fe、CuSO4溶液、MgCl2溶液 |
向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示.乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.则下列说法不正确的是( )

| A、若t1=15s,则t0-t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L?s) |
| B、B既不是反应物,也不是生成物,可能是反应的催化剂 |
| C、若t2-t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变小 |
| D、该反应为放热反应,t5-t6阶段是升高反应体系的温度 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA |
| B、Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4 NA |
| C、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA |
| D、0.5 mol?L-1CuCl2溶液中含有Cu2+数小于0.5 NA |