题目内容
2.写出下列反应的化学方程式:③Ba(OH)2与H2SO4反应:Ba(OH)2+H2SO4=BaSO4↓+H2O;
④Na2CO3与HCl反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
⑤CuSO4与NaOH溶液反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
分析 ③Ba(OH)2与H2SO4反应生成硫酸钡和水;
④Na2CO3与HCl反应生成氯化钠、水和二氧化碳;
⑤CuSO4与NaOH溶液反应生成氢氧化铜、硫酸钠.
解答 解:③Ba(OH)2与H2SO4反应生成硫酸钡和水,反应的化学方程式为Ba(OH)2+H2SO4=BaSO4↓+H2O,故答案为:Ba(OH)2+H2SO4=BaSO4↓+H2O;
④Na2CO3与HCl反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
⑤CuSO4与NaOH溶液反应生成氢氧化铜、硫酸钠,反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,
故答案为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
点评 本题考查化学方程式的书写,为高频考点,侧重于元素化合物知识的考查,注意把握相关物质的性质,难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
12.下列各物质所含原子数目按由大到小顺序排列的是( )
①0.6mol NH3 ②0.2mol H3PO4 ③9g H2O ④标准状况下22.4L He.
①0.6mol NH3 ②0.2mol H3PO4 ③9g H2O ④标准状况下22.4L He.
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ①②④③ |
13.美国现任总统奥巴马就环境问题公开表示,到2020年,美国将会把温室气体排放量削减到1990年水平的80%,此外美国将把新能源比重提高到30%.下列说法不正确的是( )
| A. | CO2属于温室气体 | |
| B. | 太阳能电池可将太阳能转化为电能 | |
| C. | 太阳能、风能和生物能源属于新能源 | |
| D. | 乙醇属不可再生能源,乙醇燃烧不会产生温室气体 |
10.100mL6mol/L硫酸跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不能影响生成氢气的总量,可向反应物中加入适量的( )
①醋酸钠固体 ②水 ③硫酸钾固体 ④硝酸钾固体 ⑤固体铜.
①醋酸钠固体 ②水 ③硫酸钾固体 ④硝酸钾固体 ⑤固体铜.
| A. | ④⑤ | B. | ①② | C. | ①②③⑤ | D. | ①②③④ |
17.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1molC2H6中含有6 NA个共价键 | |
| B. | 7.8 g Na2O2中含有的阳离子数和阴离子数均为0.2NA | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 5.6g金属铁与足量盐酸反应时失去的电子数是0.3NA |
7.若某原子的摩尔质量是Mg•mol-1,则一个该原子的真实质量是( )
| A. | Mg | B. | Mg | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | Mg |
4.下列叙述正确的是( )
| A. | 锅炉水垢中的CaSO4经饱和碳酸钠溶液浸泡可转化为CaCO3 | |
| B. | 常温下,在含有Ag+和Cl-的溶液中,Ag+和Cl-浓度之积是个常数 | |
| C. | 当醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则溶液的导电能力一定变强 | |
| D. | 将浓度为0.1 mol/L的HF溶液加水不断稀释,溶液$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
5.向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
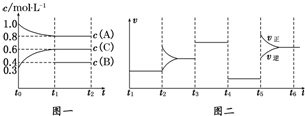
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.02 mol/(L•min).
(2)t4~t5阶段改变的条件为减小压强,B的起始物质的量为1.0 mol.各阶段平衡时对应的平衡常数如下表所示:
则K1=0.84(保留两位小数),K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”、“<”或“=”连接).
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200a kJ/mol.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4,b+$\frac{1}{3}$c=1.2.

(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.02 mol/(L•min).
(2)t4~t5阶段改变的条件为减小压强,B的起始物质的量为1.0 mol.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200a kJ/mol.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4,b+$\frac{1}{3}$c=1.2.