题目内容
11.以下指定反应的离子方程式正确的是( )| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
分析 A.至SO42-恰好沉淀完全,反应生成硫酸钡、氢氧化铝和一水合氨;
B.反应生成苯酚和碳酸氢钠;
C.发生氧化还原反应,电子、电荷不守恒;
D.1:1反应生成沉淀,沉淀与盐酸反应1:3.
解答 解:A.至SO42-恰好沉淀完全,反应生成硫酸钡、氢氧化铝和一水合氨,离子反应为NH4++Al3++2SO42-+2Ba2+4OH-=NH3.H2O+Al(OH)3↓+2BaSO4,故A错误;
B.反应生成苯酚和碳酸氢钠,离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故B错误;
C.发生氧化还原反应,电子、电荷不守恒,离子反应为3FeO+10H++NO3-═3Fe3++NO↑+5H2O,故C错误;
D.1:1反应生成沉淀,沉淀与盐酸反应1:3,则将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合的离子反应为4AlO2-+7H++H2O═3Al(OH)3↓+Al3+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.已知反应CO(g)+Cl2(g)?COCl2(g)在某温度恒容条件下进行,反应开始时c(CO)=0.0350mol•L-1,c(Cl2)=0.0270mol•L-1,c(COCl2)=0.011 mol•L-1,达到平衡时,C(COCl2)=0.032mol•L-1.该条件下氯气的转化率是( )
| A. | 60% | B. | 77.8% | C. | 48.0% | D. | 34.4% |
6.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
16.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2 | |
| B. | 将lmol Cl2通人水中,HClO、Cl一、ClO-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4 NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
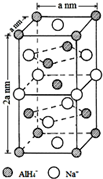 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).