题目内容
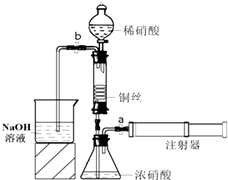 某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:
某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2 (OH)2 CO3].
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状.
Ⅲ.按右图所示连接仪器、检查气密性、装入化学试剂.
(1)过程Ⅰ发生反应的离子方程式是
(2)过程Ⅱ将铜丝做成螺旋状的目的是
(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触,操作是
②控制b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体产生.烧杯中NaOH溶液的作用是
(4)将3支盛满红棕色气体的小试管分别倒置在盛有等质量不同温度的水的3只烧杯中,发现液面上升的高度明显不一致.结果如下表所示:
| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管
| ||
| 2 | 50 | 不足试管
| ||
| 3 | 0 | 液面上升超过实验1 |
②为了探究产生此不同现象的原因,他们查阅资料如下:
资料一.NO2与水反应的实际过程为:2NO2+H2O═HNO3+HNO2 3HNO2═HNO3+2NO↑+H2O
资料二.HNO2不稳定,受热易分解.由资料分析产生上述现象的原因是
(5)3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为
②所生成的NO在标准状况下体积为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)稀硫酸和铜锈反应生成硫酸铜、二氧化碳和水;
(2)根据外界条件(反应物接触面积)对化学反应速率的影响分析;
(3)①根据气体压强对浓硝酸的影响分析;金属铜可以和浓硝酸反应产生二氧化氮红棕色气体;
(4)①根据表格分析温度和液面上升高度的关系;
②通过表格中温度和液面上升高度的关系,分析亚硝酸的分解对液面上升高度的影响;
(5)①铜与过量的硝酸,反应后溶液中所含H+离子为amol,说明溶液为Cu(N03)2与HN03的混合溶液,溶液中n(N03-)=n(H+)+2n(Cu2+),据此计算;
②根据电子守恒和元素守恒计算一氧化氮的物质的量以及标况下的体积.
(2)根据外界条件(反应物接触面积)对化学反应速率的影响分析;
(3)①根据气体压强对浓硝酸的影响分析;金属铜可以和浓硝酸反应产生二氧化氮红棕色气体;
(4)①根据表格分析温度和液面上升高度的关系;
②通过表格中温度和液面上升高度的关系,分析亚硝酸的分解对液面上升高度的影响;
(5)①铜与过量的硝酸,反应后溶液中所含H+离子为amol,说明溶液为Cu(N03)2与HN03的混合溶液,溶液中n(N03-)=n(H+)+2n(Cu2+),据此计算;
②根据电子守恒和元素守恒计算一氧化氮的物质的量以及标况下的体积.
解答:
解:(1)过程Ⅰ发生稀硫酸和铜锈反应,生成硫酸铜、二氧化碳和水,即:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O;
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O;
(2)过程Ⅱ将铜丝做成螺旋状,这样反应物的接触面积增大,化学反应速率加快,即将铜丝做成螺旋状,增大了铜和硝酸的接触面积,提高了化学反应速率,
故答案为:增大铜丝与酸的接触面积,提高化学反应速率;
(3)①利用锥形瓶中气压将浓硝酸压入玻璃管使浓硝酸和铜反应,要想使该实验发生,需将止水夹a和b打开,从注射器中推入空气;当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器,此时铜和浓硝酸反应生成碳酸铜、二氧化氮和水,即Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,
故答案为:打开止水夹a和b,从注射器中推入空气;Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
②氢氧化钠可以和含氮的氧化物之间反应NO+NO2+2NaOH═2NaNO2+H2O,防止有毒气体污染空气,
故答案为:对含氮氧化物进行尾气处理;
(4)①根据表格知,温度越低,进入试管中的溶液体积越多,
故答案为:温度越低,进入试管中的溶液体积越多;
②HNO2不稳定,分解生成一氧化氮,温度越低,进入试管中的溶液体积越多,说明HNO2分解产生的NO气体量越少,一氧化氮所占体积越小,进入试管中的溶液体积越多,
故答案为:温度低,HNO2分解量减少,分解产生的NO气体量减少,且生成的NO所占体积小,所以进入试管中的溶液体积增大.
(5)①3.2g铜的物质的量为
=0.05mol.铜与过量的硝酸,反应后溶液中所含H+离子为amol,说明所得到的溶液为Cu(N03)2与HN03的混合溶液,根据电荷守恒溶液中n(N03-)=n(H+)+2n(Cu2+)=amol+0.05mol×2=(a+0.1)mol,故答案为:(a+0.1);
②根据电子守恒,设生成的NO的物质的量是x,二氧化氮的物质的量是y,则3x+y=0.05×2,0.03L×8mol/L=x+y+(a+0.1),解得x=0.5a-0.02,生成的NO的物质的量是(0.5a-0.02)mol,标况下的体积是22.4(0.5a-0.02)=(11.2a-0.448)L,故答案为:11.2a-0.448.
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O;
(2)过程Ⅱ将铜丝做成螺旋状,这样反应物的接触面积增大,化学反应速率加快,即将铜丝做成螺旋状,增大了铜和硝酸的接触面积,提高了化学反应速率,
故答案为:增大铜丝与酸的接触面积,提高化学反应速率;
(3)①利用锥形瓶中气压将浓硝酸压入玻璃管使浓硝酸和铜反应,要想使该实验发生,需将止水夹a和b打开,从注射器中推入空气;当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器,此时铜和浓硝酸反应生成碳酸铜、二氧化氮和水,即Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,
故答案为:打开止水夹a和b,从注射器中推入空气;Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
②氢氧化钠可以和含氮的氧化物之间反应NO+NO2+2NaOH═2NaNO2+H2O,防止有毒气体污染空气,
故答案为:对含氮氧化物进行尾气处理;
(4)①根据表格知,温度越低,进入试管中的溶液体积越多,
故答案为:温度越低,进入试管中的溶液体积越多;
②HNO2不稳定,分解生成一氧化氮,温度越低,进入试管中的溶液体积越多,说明HNO2分解产生的NO气体量越少,一氧化氮所占体积越小,进入试管中的溶液体积越多,
故答案为:温度低,HNO2分解量减少,分解产生的NO气体量减少,且生成的NO所占体积小,所以进入试管中的溶液体积增大.
(5)①3.2g铜的物质的量为
| 3.2g |
| 64g/mol |
②根据电子守恒,设生成的NO的物质的量是x,二氧化氮的物质的量是y,则3x+y=0.05×2,0.03L×8mol/L=x+y+(a+0.1),解得x=0.5a-0.02,生成的NO的物质的量是(0.5a-0.02)mol,标况下的体积是22.4(0.5a-0.02)=(11.2a-0.448)L,故答案为:11.2a-0.448.
点评:本题以硝酸的性质为载体考查了铜和硝酸的实验以及电子守恒在氧化还原反应中的计算知识,难度较大,注意基础知识的积累.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、NaAlO2溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ |
| C、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |
在一密闭容器中,反应aA(g)?bB(g)达平衡(Ⅰ).保持稳定不变,将容器体积增加一倍,当达到新的平衡(Ⅱ)时,实验测得cB(Ⅱ):cB(Ⅰ)=2:5,则下列说法正确的是( )
| A、平衡向正反应方向移动 |
| B、a<b |
| C、物质B的质量分数增加 |
| D、物质A的转化率降低 |
 实验室进行某项实验并检验反应产物的装置如图.
实验室进行某项实验并检验反应产物的装置如图.
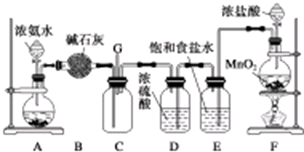 某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.请回答下列问题:
某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.请回答下列问题: