题目内容
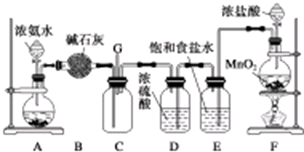 某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.请回答下列问题:
某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.请回答下列问题:(1)装置F中发生反应的离子方程式为
(2)NH3的结构式为
(3)E装置的作用
(4)通入C装置的两根导管左边较长、右边较短,目的是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
(6)该实验明显需要改进之处是
考点:氨的制取和性质,氯气的实验室制法
专题:实验题
分析:(1)二氧化锰可以和浓盐酸在加热条件下生成氯气,根据离子方程式的书写方法来书写;
(2)氨气是共价化合物;
(3)碱石灰可以干燥氨气,饱和食盐水可以除去氯气中的氯化氢杂质;
(4)根据气体的密度大小结合导管的长度来考虑气体之间混合的充分程度;
(5)氨气和氯气反应生成氯化铵和氮气;
(6)根据氯气的性质来确定尾气处理的方法.
(2)氨气是共价化合物;
(3)碱石灰可以干燥氨气,饱和食盐水可以除去氯气中的氯化氢杂质;
(4)根据气体的密度大小结合导管的长度来考虑气体之间混合的充分程度;
(5)氨气和氯气反应生成氯化铵和氮气;
(6)根据氯气的性质来确定尾气处理的方法.
解答:
解:(1)二氧化锰可以和浓盐酸在加热条件下生成氯气,反应的实质为:MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O;
故答案为:MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O;
(2)氨气是共价化合物结构式为, 故答案为:
故答案为: ;
;
(3)B装置中,可以用碱石灰干燥氨气,E装置中,可以用饱和食盐水除去氯气中的氯化氢杂质;
故答案为:除去氯气中的氯化氢;
(4)氨气的密度小,氯气的密度更大,C装置的两导管左边长、右边短,这样便于两种气体充分接触而反应;
故答案为:因为氨气的密度小,氯气的密度更大,这样便于两种气体充分接触而反应;
(5)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即8NH3+3Cl2═6NH4Cl+N2;
故答案为:8NH3+3Cl2═6NH4Cl+N2;
(6)氯气是酸性气体,可以用氢氧化钠来进行尾气处理,或者是通入装有碱石灰的干燥管或气球收集,G处接NaOH溶液的尾气处理装置;
故答案为:G处接NaOH溶液的尾气处理装置;
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)氨气是共价化合物结构式为,
 故答案为:
故答案为: ;
;(3)B装置中,可以用碱石灰干燥氨气,E装置中,可以用饱和食盐水除去氯气中的氯化氢杂质;
故答案为:除去氯气中的氯化氢;
(4)氨气的密度小,氯气的密度更大,C装置的两导管左边长、右边短,这样便于两种气体充分接触而反应;
故答案为:因为氨气的密度小,氯气的密度更大,这样便于两种气体充分接触而反应;
(5)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即8NH3+3Cl2═6NH4Cl+N2;
故答案为:8NH3+3Cl2═6NH4Cl+N2;
(6)氯气是酸性气体,可以用氢氧化钠来进行尾气处理,或者是通入装有碱石灰的干燥管或气球收集,G处接NaOH溶液的尾气处理装置;
故答案为:G处接NaOH溶液的尾气处理装置;
点评:本题考查学生实验室制取氯气、氨气的方法、干燥、性质等方面的知识考查角度广,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
在18世纪70年代,首先发现并制得氯气的化学家是( )
| A、舍勒 | B、戴维 | C、玻尔 | D、侯德榜 |
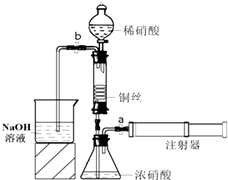 某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:
某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下: 用如图装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
用如图装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:

 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.