题目内容
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、NaAlO2溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ |
| C、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.根据反应实质进行分析,反应前后氧原子不相等;
B.NaAlO2溶液中加入过量稀盐酸,先生成氢氧化铝沉淀,后沉淀溶解;
C.碳酸酸性大于氢氧化铝,将二氧化碳通到偏铝酸钠的溶液中,偏铝酸钠溶液与二氧化碳反应生成了氢氧化铝和碳酸氢钠;
D.Al2O3既能跟盐酸反应又能跟NaOH溶液反应,Al2O3粉末溶于NaOH溶液中生成偏铝酸钠和水;
B.NaAlO2溶液中加入过量稀盐酸,先生成氢氧化铝沉淀,后沉淀溶解;
C.碳酸酸性大于氢氧化铝,将二氧化碳通到偏铝酸钠的溶液中,偏铝酸钠溶液与二氧化碳反应生成了氢氧化铝和碳酸氢钠;
D.Al2O3既能跟盐酸反应又能跟NaOH溶液反应,Al2O3粉末溶于NaOH溶液中生成偏铝酸钠和水;
解答:
解:A.2Al+2OH-=2AlO2-+H2↑,反应前2个氧原子,反应后4个氧原子,前后氧原子不相等,正确的方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故A错误;
B.NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,加入过量稀盐酸发生反应,Al(OH)3+3HCl=AlCl3+3H2O,总离子方程式为:AlO2-+4H+=Al3++2H2O,故B错误;
C.偏铝酸钠溶液中通入过量二氧化碳,反应生成了氢氧化铝沉淀和碳酸氢钠,反应的化学方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故C错误;
D.氧化铝为两性氧化物,可与强碱反应,Al2O3粉末溶于NaOH溶液中,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故D正确;
故选D.
B.NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,加入过量稀盐酸发生反应,Al(OH)3+3HCl=AlCl3+3H2O,总离子方程式为:AlO2-+4H+=Al3++2H2O,故B错误;
C.偏铝酸钠溶液中通入过量二氧化碳,反应生成了氢氧化铝沉淀和碳酸氢钠,反应的化学方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故C错误;
D.氧化铝为两性氧化物,可与强碱反应,Al2O3粉末溶于NaOH溶液中,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,为高考常见题型,掌握元素及其化合物的性质,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意注意通入的过量二氧化碳能否与产物继续反应是该题易错点,题目难度中等.

练习册系列答案
相关题目
将10mL 5mol?L-1的盐酸稀释到200mL,则此时溶液的物质的量浓度是( )
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
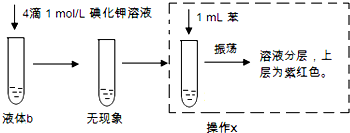 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.

 实验,此实验过程涉及的反应类型有
实验,此实验过程涉及的反应类型有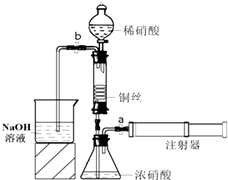 某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:
某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下: