题目内容
下列有关说法正确的是( )
| A、恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变 |
| B、0.1mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、对于N2(g)+3H2(g)=2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
考点:离子浓度大小的比较,化学反应速率的影响因素,难溶电解质的溶解平衡及沉淀转化的本质
专题:盐类的水解专题
分析:A.水的离子积常数只受温度的影响;
B.电荷不守恒;
C.增大浓度,正逆反应速率都增大;
D.当离子的浓度幂之积大于溶度积时,有沉淀生成,但不能证明Ksp(BaSO4)>Ksp(BaCO3).
B.电荷不守恒;
C.增大浓度,正逆反应速率都增大;
D.当离子的浓度幂之积大于溶度积时,有沉淀生成,但不能证明Ksp(BaSO4)>Ksp(BaCO3).
解答:
解:A.水的离子积常数只受温度的影响,温度不变,则离子积常数不变,故A正确;
B.CH3COONa为强碱弱酸盐,水解呈碱性,应为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.增大浓度,正逆反应速率都增大,故C错误;
D.当离子的浓度幂之积大于溶度积时,有沉淀生成,但不能证明Ksp(BaSO4)>Ksp(BaCO3),应加入少量溶液时,如生成沉淀,可说明溶度积关系,事实上Ksp(BaSO4)<Ksp(BaCO3),故D错误.
故选A.
B.CH3COONa为强碱弱酸盐,水解呈碱性,应为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.增大浓度,正逆反应速率都增大,故C错误;
D.当离子的浓度幂之积大于溶度积时,有沉淀生成,但不能证明Ksp(BaSO4)>Ksp(BaCO3),应加入少量溶液时,如生成沉淀,可说明溶度积关系,事实上Ksp(BaSO4)<Ksp(BaCO3),故D错误.
故选A.
点评:本题考查较为综合,涉及离子浓度大小比较、反应速率的影响因素以及难溶电解质的溶解平衡,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握盐类水解和弱电解质的电离特点,结合物料守恒、电荷守恒解答该题,难度中等.

练习册系列答案
相关题目
下列关于化学与生活的认识不正确的是( )
| A、CaO能与SO2反应,CaO可作工业废气的脱硫剂 |
| B、同浓度的Na2CO3溶液在不同温度下的去污能力不同 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
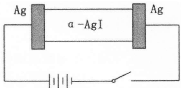 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |
下列各组离子在指定的溶液中一定能大量共存的是( )
| A、碱性溶液中:K+、Ba2+、Cl-、NO3- |
| B、酸性溶液中:Na+、Fe2+、NO3-、SO42- |
| C、能与Al反应生成H2的溶液:Mg2+、K+、NO3-、Cl- |
| D、澄清透明溶液中:Na+、H+、AlO2-、MnO4- |
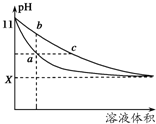 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A、a点导电能力比b点强 |
| B、对于b、c两点,Kb>Kc |
| C、与盐酸完全反应时,消耗盐酸体积Va>Vc |
| D、X的值接近7,但大于7 |
下列各溶液中,物质的量浓度关系正确的是( )
| A、0.1mol?L-1的KA1(SO4)2溶液中:c(SO42-)>c(K+)>c(A13+)>c(H+)>c(OH-) |
| B、10mL 0.01mo1?L-1HCl溶液与10mL 0.01mo1?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C、在0.1mol?L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
下列溶液中微粒浓度关系一定正确的是( )
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C、常温下,等物质的量浓度的三种溶液①(NH4)2SO4 ②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):②<①<③ |
| D、0.1mol?L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |

 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.