题目内容
15.下列各有机物的分类或命名不正确的是( )| A. | 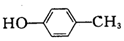 对甲苯酚 属于芳香化合物 对甲苯酚 属于芳香化合物 | B. | 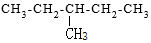 3-甲基戊烷 属于烷烃 3-甲基戊烷 属于烷烃 | ||
| C. | 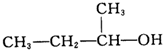 2-甲基-1-丙醇-元醇 2-甲基-1-丙醇-元醇 | D. | 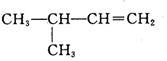 3-甲基-1-丁烯 属于脂肪烃 3-甲基-1-丁烯 属于脂肪烃 |
分析 A.含酚-OH;
B.为饱和烃;
C.含-OH,且含-OH的最长碳链含4个C原子;
D.含碳碳双键,且含双键的最长碳链有4个C,3号C上有甲基.
解答 解:A.含酚-OH,-OH与甲基位于苯环的对位,则名称为对甲苯酚,含苯环属于芳香化合物,故A正确;
B.为饱和烃,名称为3-甲基戊烷,属于烷烃,故B正确;
C.含-OH,且含-OH的最长碳链含4个C原子,则名称为2-丁醇,故C错误;
D.含碳碳双键,且含双键的最长碳链有4个C,3号C上有甲基,则名称为3-甲基-1-丁烯,由链状结构可知属于脂肪烃,故D正确;
故选C.
点评 本题考查有机物的官能团及名称,为高频考点,把握有机物的结构、官能团、分类为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.如图为某装置的示意图,下列说法中不正确的是( )


| A. | 该装置将化学能转化为电能 | |
| B. | Zn棒与Cu棒作用一样,都只做电极材料 | |
| C. | Cu棒上发生还原反应 | |
| D. | 该装置发生反应的离子方程式是:Zn+Cu2+=Zn2++Cu |
3.下列有关电化学装置的叙述正确的是( )
| A. |  图中,Zn-MnO2干电池放电时,MnO2被氧化 | |
| B. |  图中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 | |
| C. |  图中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl7- | |
| D. |  图中,K分别与M、N连接,均可保护Fe电极,连接M时为“牺牲阳极的阴极保护法” |
10.下列说法中,正确的是( )
| A. | 非金属元素之间只能形成共价化合物 | |
| B. | 第IA族元素的金属性一定比IIA族元素的金属性强 | |
| C. | 短周期中,同周期元素的离子半径从左到右逐渐减小 | |
| D. | 非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
3. 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).
(1)该反应的平衡常数表达式是K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,由表中数据判断△H<0 (填“>”、“=”或“<”);
(2)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小w为原来的$\frac{1}{2}$,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).| 温度 | 250℃ | 300℃ | 350℃ |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
(2)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小w为原来的$\frac{1}{2}$,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
8.下列属于油脂用途的是( )
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制备高级脂肪酸 ⑤制备汽油.
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制备高级脂肪酸 ⑤制备汽油.
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | ②③④⑤ |
 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池. 主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题: .
. )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )


