题目内容
3. 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).| 温度 | 250℃ | 300℃ | 350℃ |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
(2)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小w为原来的$\frac{1}{2}$,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
分析 (1)平衡常数为生成物与反应物浓度幂之积的比值,升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
(2)根据平衡浓度计算出平衡常数来确定温度;根据v=$\frac{△c}{△t}$计算反应速率;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动;
(4)碱性条件下,甲醇在负极被氧化生成碳酸根离子和水.
解答 解:(1)平衡常数为生成物与反应物浓度幂之积的比值,对于CO(g)+2H2(g)?CH3OH(g),破坏常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;<;
(2)CO(g)+2H2(g)?CH3OH(g)
开始 1mol/L 3mol/L 0
转化 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8}{0.2×1.{4}^{2}}$=2.04,所以是250℃;
反应速率v(H2)=$\frac{1.6mol/L}{5min}$=0.32 mol•L-1•min-1,
故答案为:250℃;0.32 mol•L-1•min-1;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至新平衡,图示如下:
假定在t2时刻后又达到新的平衡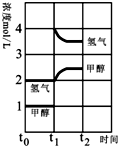 ;
;
故答案为: ;
;
(4)用CH3OH和空气作燃料电池,用KOH作电解质溶液,负极CH3OH失电子发生氧化反应,则负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题综合考查化学破坏的计算,涉及影响化学平衡移动的因素、速率的计算、电极反应式的书写等知识点,为高考常见题型,难度大,有利于提高学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Z元素与氯元素通过离子键化合形成对应的氯化物 | |
| B. | 原子半径:Y>Z>W>X | |
| C. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 | |
| D. | 气态氢化物的热稳定性:X>W |
| A. | pH=0的溶液中:NO3-、SO42-、Na+、I-能大量共存 | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)=2c(S2-) | |
| C. | NaHSO3溶液中:c(HSO3-)+c(OH-)+c(SO32-)=c(H+)+c(Na+) | |
| D. | 等体积的硝酸和氨水混合可能存在:c(NO3-)=c(NH4+) |
| A. | 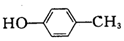 对甲苯酚 属于芳香化合物 对甲苯酚 属于芳香化合物 | B. | 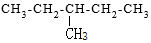 3-甲基戊烷 属于烷烃 3-甲基戊烷 属于烷烃 | ||
| C. | 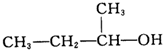 2-甲基-1-丙醇-元醇 2-甲基-1-丙醇-元醇 | D. | 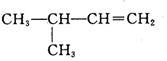 3-甲基-1-丁烯 属于脂肪烃 3-甲基-1-丁烯 属于脂肪烃 |
| A. | O2和O3 | B. | 1H2和2H2 | C. | 234U和235U | D. | C60和14C |
 S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂.实验室常用CS2与纯净的氯气制备S2C12.反应涉及到的几种物质的熔沸点如表:
S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂.实验室常用CS2与纯净的氯气制备S2C12.反应涉及到的几种物质的熔沸点如表:| 物质 | CS2 | Cl2 | CCl4 | S2C12 |
| 沸点/℃ | 47 | -34.6℃ | 77 | 137 |
| 熔点/℃ | -109 | -100.98℃ | -23 | -77 |
回答下列问题:
(1)装置中b玻璃仪器的名称为冷凝管;写出制备S2C12的化学方程式CS2+3Cl2$\stackrel{111-140℃}{→}$CCl4+S2Cl2.
(2)整套装置装配完毕后,首先进行的操作是气密性检查,再添加试剂.
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.装置A中反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是D和E之间应连接一个干燥装置,避免S2C12水解.
| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Fe与足量的该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的硫酸需取该硫酸50 mL | |
| D. | 等质量的水与该硫酸混合后所得溶液的物质的量浓度大于9.2 mol/L |
 利用如图装置验证同主族或同周期元素递变规律.
利用如图装置验证同主族或同周期元素递变规律.
 .
.