题目内容
6.如图为某装置的示意图,下列说法中不正确的是( )
| A. | 该装置将化学能转化为电能 | |
| B. | Zn棒与Cu棒作用一样,都只做电极材料 | |
| C. | Cu棒上发生还原反应 | |
| D. | 该装置发生反应的离子方程式是:Zn+Cu2+=Zn2++Cu |
分析 该原电池中,Zn易失电子作负极,Cu作正极,正极上铜离子得电子生成铜,原电池是把化学能转化为电能的装置,据此分析解答.
解答 解:A.原电池是把化学能转化为电能的装置,故A正确;
B.负极Zn失电子生成锌离子,正极上铜离子得电子生成铜,所以Zn棒参与反应,与Cu棒作用不一样,故B错误;
C.Cu作正极,正极上铜离子得电子发生还原反应生成铜,故C正确;
D.负极Zn失电子生成锌离子,正极上铜离子得电子生成铜,则原电池发生反应的离子方程式是:Zn+Cu2+=Zn2++Cu,故D正确;
故选B.
点评 本题考查了原电池原理,根据电极上得失电子确定正负极,原电池概念来分析解答,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
14.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O
②加NaOH固体
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
①加H2O
②加NaOH固体
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
| A. | ①⑥⑦ | B. | ③⑤ | C. | ③⑦ | D. | ⑤⑦ |
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Al3+含有的核外电子数为3NA | |
| B. | 将5.85 g NaCl溶于100g水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1 mol Cl2与足量的铁反应,转移的电子数为2NA | |
| D. | 常温下,pH=1的硫酸溶液中含有的H+数为NA |
18.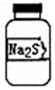 实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )
实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )
 实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )
实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )| A. | 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 | |
| B. | 往溶液中加入稀盐酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 | |
| C. | 用pH试纸检验,若pH=7,则固体M不一定是Na2SO4 | |
| D. | 只用盐酸一种试剂不能确定该固体M的具体成分 |
15.下列各有机物的分类或命名不正确的是( )
| A. | 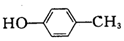 对甲苯酚 属于芳香化合物 对甲苯酚 属于芳香化合物 | B. | 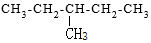 3-甲基戊烷 属于烷烃 3-甲基戊烷 属于烷烃 | ||
| C. | 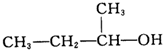 2-甲基-1-丙醇-元醇 2-甲基-1-丙醇-元醇 | D. | 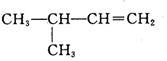 3-甲基-1-丁烯 属于脂肪烃 3-甲基-1-丁烯 属于脂肪烃 |
19.在 100kpa 时,1mol 金刚石转化为石墨要放出 1.895kJ的热量.下列结论正确的是( )
| A. | 在 100kpa 时金刚石比石墨稳定 | |
| B. | 在 100kpa 时石墨比金刚石稳定 | |
| C. | 金刚石和石墨是碳元素的两种同位素 | |
| D. | 断裂 1mol 金刚石的化学键会放出能量 |
 利用如图装置验证同主族或同周期元素递变规律.
利用如图装置验证同主族或同周期元素递变规律.