题目内容
(1)在如图所示的元素周期表中全部是金属元素的区域为 .
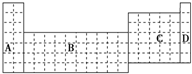
a.A b.B c.C d.D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表现都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 .
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
d.比较这两种元素的气态氢化物的稳定性
(3)丙是常见的化合物,其化学式为XCl3.X代表的元素符号可能为 (要求写出两种位于不同族的元素).

a.A b.B c.C d.D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表现都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
d.比较这两种元素的气态氢化物的稳定性
(3)丙是常见的化合物,其化学式为XCl3.X代表的元素符号可能为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)周期表中的B区域是过渡金属区,全是金属元素;
(2)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表现都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg,其中Mg的金属性比Al的强.比较元素金属性强弱的常用方法有:①单质与酸反应情况;②单质与水反应情况;③比较最高价氧化物的水化物的碱性强弱等.在空气中放置已久的这两种元素的块状单质,表面会形成氧化膜,对单质与热水的反应速率会有影响;
(3)X的化合价为+3,若为主族元素应想到ⅢA族的元素,教材中常见的为B、Al,ⅤA族中的N、P分别能形成NCl3、PCl3,第4周期中的Fe也有+3价.
(2)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表现都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg,其中Mg的金属性比Al的强.比较元素金属性强弱的常用方法有:①单质与酸反应情况;②单质与水反应情况;③比较最高价氧化物的水化物的碱性强弱等.在空气中放置已久的这两种元素的块状单质,表面会形成氧化膜,对单质与热水的反应速率会有影响;
(3)X的化合价为+3,若为主族元素应想到ⅢA族的元素,教材中常见的为B、Al,ⅤA族中的N、P分别能形成NCl3、PCl3,第4周期中的Fe也有+3价.
解答:
解:(1)周期表中的B区域是过渡金属区,全是金属元素,A区的氢为非金属元素,C区既有金属元素又有非金属元素,D区为稀有气体元素,故选:b;
(2)①根据题中叙述可推知甲为Al,乙为Mg,在周期表中相对位置为: ,
,
故答案为: ;
;
②Mg的金属性比Al的强.比较元素金属性强弱的常用方法有:①单质与酸反应情况;②单质与水反应情况;③比较最高价氧化物的水化物的碱性强弱等.在空气中放置已久的这两种元素的块状单质,金属表面会形成氧化膜,对单质与热水的反应速率会有影响,不能比较金属氢化物稳定性判断金属性强弱,故ad错误,bc正确,
故答案为:镁;bc;
(3)X的化合价为+3,若为主族元素应想到ⅢA族的元素,教材中常见的为B、Al,ⅤA族中的N、P分别能形成NCl3、PCl3,第4周期中的Fe也有+3价,
故答案为:Al、P等.
(2)①根据题中叙述可推知甲为Al,乙为Mg,在周期表中相对位置为:
 ,
,故答案为:
 ;
;②Mg的金属性比Al的强.比较元素金属性强弱的常用方法有:①单质与酸反应情况;②单质与水反应情况;③比较最高价氧化物的水化物的碱性强弱等.在空气中放置已久的这两种元素的块状单质,金属表面会形成氧化膜,对单质与热水的反应速率会有影响,不能比较金属氢化物稳定性判断金属性强弱,故ad错误,bc正确,
故答案为:镁;bc;
(3)X的化合价为+3,若为主族元素应想到ⅢA族的元素,教材中常见的为B、Al,ⅤA族中的N、P分别能形成NCl3、PCl3,第4周期中的Fe也有+3价,
故答案为:Al、P等.
点评:本题考查元素周期表与元素周期律综合应用,比较基础,注意掌握元素金属性、非金属性强弱比较及实验事实.

练习册系列答案
相关题目
下列过程与蛋白质变性无关的是( )
| A、用煮沸的方法可消毒医疗器械 |
| B、用福尔马林保存生物标本 |
| C、鸡蛋白加入(NH4)2SO4溶液,可以观察到有沉淀析出 |
| D、鸡蛋白溶液里加入少量乙酸铅溶液,可以观察到有沉淀生成 |