题目内容
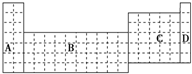
下表为元素周期表的一部分.
(1)表中元素 的非金属性最强;元素 的金属性最强;元素 的单质室温下呈液态(填写元素符号);
(2)表中元素(12)的原子结构示意图是 ;
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为 > > (填写化学式,下同);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性: > .
族 周期 | ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
(2)表中元素(12)的原子结构示意图是
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、⑾为K、⑿为Ga、⒀为Br.
(1)同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;上述原子中溴的单质常温下为液态;
(2)⑿为Ga,原子核外有31个电子,有4个电子层,各层电子数为2、8、18、3;
(3)非金属性越强,氢化物越稳定;
(4)非金属性越强,最高价含氧酸的酸性越强.
(1)同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;上述原子中溴的单质常温下为液态;
(2)⑿为Ga,原子核外有31个电子,有4个电子层,各层电子数为2、8、18、3;
(3)非金属性越强,氢化物越稳定;
(4)非金属性越强,最高价含氧酸的酸性越强.
解答:
解:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、⑾为K、⑿为Ga、⒀为Br.
(1)同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,上述元素中F元素非金属性最强,K的金属性最强;上述原子中溴的单质常温下为液态,
故答案为:F;K;Br;
(2)⑿为Ga,原子核外有31个电子,有4个电子层,各层电子数为2、8、18、3,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)非金属性F>Cl>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>HCl>H2S,故答案为:HF>HCl>H2S;
(4)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4;H2SO4.
(1)同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,上述元素中F元素非金属性最强,K的金属性最强;上述原子中溴的单质常温下为液态,
故答案为:F;K;Br;
(2)⑿为Ga,原子核外有31个电子,有4个电子层,各层电子数为2、8、18、3,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(3)非金属性F>Cl>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>HCl>H2S,故答案为:HF>HCl>H2S;
(4)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4;H2SO4.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,侧重对元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、NA个氢分子与NA个氧分子的质量比为1:1 |
| B、1mol氢气的质量与NA个氢分子的质量和相等 |
| C、16g氧气中含有的氧分子数为NA |
| D、44g CO2与28g CO所含有的分子数均为NA |
为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL 0.1mol?L-1KI溶液中滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应.下列实验操作能说明该反应存在限度的是( )
| A、再滴加AgNO3溶液,观察是否有黄色沉淀产生 |
| B、再加入CCl4振荡后,观察下层液体颜色是否变为紫红色 |
| C、再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生 |
| D、再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色 |
F2和Br2的沸点相比较,前者与后者的关系是( )
| A、大于 | B、小于 |
| C、等于 | D、不能确定 |
 某学校化学科研小组使用一些废旧物品组装了一个简易装置,用来测定乙醇的燃烧热,过程如下:
某学校化学科研小组使用一些废旧物品组装了一个简易装置,用来测定乙醇的燃烧热,过程如下: