题目内容
已知A、B、C、D均为中学化学的常见物质,它们之间的反应关系如图所示: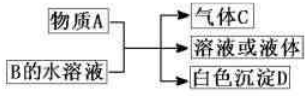
(1)若A是短周期主族元素中原子半径最大的元素构成的单质,D既可溶于盐酸又可溶于NaOH溶液.图示中的离子方程式为 .
(2)若C是一种四原子分子,分子中四个原子在一条直线上;A与B的溶液反应只生成气体C、CaCO3和H2O,则C的电子式为 ,B的化学式为 .
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离子;D不溶于稀硝酸.则A的化学式为 ,B的溶液中各离子浓度由大到小的顺序为 .

(1)若A是短周期主族元素中原子半径最大的元素构成的单质,D既可溶于盐酸又可溶于NaOH溶液.图示中的离子方程式为
(2)若C是一种四原子分子,分子中四个原子在一条直线上;A与B的溶液反应只生成气体C、CaCO3和H2O,则C的电子式为
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离子;D不溶于稀硝酸.则A的化学式为
考点:无机物的推断
专题:推断题
分析:(1)若A是短周期主族元素中原子半径最大的元素构成的单质,则A是Na,D既可溶于盐酸又可溶于NaOH溶液,且为白色沉淀,则D是Al(OH)3,B应该为铝盐;
(2)若C是一种四原子分子,分子中四个原子在一条直线上,则C是C2H2;A与B的溶液反应只生成气体C、CaCO3和H2O,A是碳化钙、B是碳酸氢钙;
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E,则M是N元素,C是NH3,E是NH4NO3;B是一种正盐,与E含有相同的阳离子,则B是铵盐;D不溶于稀硝酸,且为白色沉淀,则A为氢氧化钡、B为硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断.
(2)若C是一种四原子分子,分子中四个原子在一条直线上,则C是C2H2;A与B的溶液反应只生成气体C、CaCO3和H2O,A是碳化钙、B是碳酸氢钙;
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E,则M是N元素,C是NH3,E是NH4NO3;B是一种正盐,与E含有相同的阳离子,则B是铵盐;D不溶于稀硝酸,且为白色沉淀,则A为氢氧化钡、B为硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断.
解答:
解:(1)若A是短周期主族元素中原子半径最大的元素构成的单质,则A是Na,D既可溶于盐酸又可溶于NaOH溶液,且为白色沉淀,则D是Al(OH)3,B应该为铝盐,钠、铝盐、水反应生成氢氧化铝、钠离子和氢气,离子方程式为6Na+2Al3++6H2O=6Na++2Al(OH)3+3H2↑,故答案为:6Na+2Al3++6H2O=6Na++2Al(OH)3+3H2↑;
(2)若C是一种四原子分子,分子中四个原子在一条直线上,则C是C2H2;A与B的溶液反应只生成气体C、CaCO3和H2O,A是碳化钙,碳化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钙反应生成碳酸钙沉淀,所以B是碳酸氢钙,乙炔分子中碳原子之间存在共价三键,氢原子和相邻碳原子共有一对电子,所以乙炔电子式为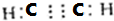 ,B为Ca(HCO3)2,
,B为Ca(HCO3)2,
故答案为: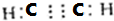 ;Ca(HCO3)2;
;Ca(HCO3)2;
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E,则M是N元素,C是NH3,E是NH4NO3;B是一种正盐,与E含有相同的阳离子,则B是铵盐;D不溶于稀硝酸,且为白色沉淀,
则A为Ba(OH)2、B为硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)>c(SO42-),铵根离子水解程度较小,所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:Ba(OH)2;c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(2)若C是一种四原子分子,分子中四个原子在一条直线上,则C是C2H2;A与B的溶液反应只生成气体C、CaCO3和H2O,A是碳化钙,碳化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钙反应生成碳酸钙沉淀,所以B是碳酸氢钙,乙炔分子中碳原子之间存在共价三键,氢原子和相邻碳原子共有一对电子,所以乙炔电子式为
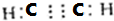 ,B为Ca(HCO3)2,
,B为Ca(HCO3)2,故答案为:
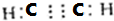 ;Ca(HCO3)2;
;Ca(HCO3)2;(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E,则M是N元素,C是NH3,E是NH4NO3;B是一种正盐,与E含有相同的阳离子,则B是铵盐;D不溶于稀硝酸,且为白色沉淀,
则A为Ba(OH)2、B为硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)>c(SO42-),铵根离子水解程度较小,所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:Ba(OH)2;c(NH4+)>c(SO42-)>c(H+)>c(OH-).
点评:本题考查无机物推断,涉及物质结构、盐类水解、离子反应等知识点,明确物质的性质是解本题关键,熟练掌握常见元素化合物结构、性质,知道盐类水解特点,题目难度不大.

练习册系列答案
相关题目
下表为四种溶液的溶质质量分数和物质的量浓度的数值
根据表中数据判断上述四种溶液中的密度最小的是( )
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数ω(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol/L) | 14.3 | 13.8 | 10.6 | 11.8 |
| A、HCl |
| B、HNO3 |
| C、CH3COOH |
| D、KOH |
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1催化剂450℃、1MPa |
| B、450℃、1MPa下,将1mol SO2和0.5molO2置于密闭的容器中充分反应生成SO3(g),放热98.5kJ,其热化学方程式为:2SO2+O2(g)?2 SO3(g)△H=-98.5kJ?mol-1 |
| C、氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D、用FeCl3溶液腐蚀铜箔:Cu+2Fe3+═2Fe2++Cu2+ |