题目内容
3.水的电离平衡为H2O?H+﹢OH-,△H>0,下列叙述不正确的是( )| A. | 将水加热,pH不变 | |
| B. | 恒温下,向水中加入少量固体KOH,c(OH-)变大 | |
| C. | 向水中滴入稀醋酸,c(H+)增大 | |
| D. | 向水中加入少量固体NaClO,平衡向右移动 |
分析 水的电离达到平衡:H2O?H++OH-,加入与H+或OH-反应的物质,改变c(OH-)或c(H+),可使平衡发生移动,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+)增大,则pH减小,Kw随温度变化.
解答 解:A、水的电离是吸热过程,加热促进电离,氢离子浓度增大,PH减小,故A错误;
B、向水中加入少量KOH固体,平衡逆向移动,c(OH-)增大,温度不变,但KW不变,故B正确;
C、向水中加入少量稀醋酸,平衡逆向移动,c(H+)增大,故C正确;
D、向水中加入少量固体NaClO,次氯酸根离子结合水电离的氢离子,促进了水的电离,水的电离平衡向着正向移动,故D正确;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
13.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,1 L pH=1的H2SO4溶液中,SO${\;}_{4}^{2-}$数目为0.1NA | |
| B. | 将7.8 g Na2O2放入足量的CO2和水蒸气组成的气体中充分反应,转移电子总数为0.1NA | |
| C. | 9 g重氧水(H${\;}_{2}^{18}$O)含电子总数为10NA | |
| D. | 常温常压下,2.24 L正戊烷、异戊烷及新戊烷的混合物,含C-H数目为1.2NA |
11.向含有amolNH4HSO4的溶液中加入bmolNaOH.下列说法不正确的是( )
| A. | 当a≥b时,发生的离子反应为H++OH-=H2O | |
| B. | 当5a=4b时,发生的离子反应为4NH4++H++5OH-=4NH3•H2O+H2O | |
| C. | 当a≤b≤$\frac{3}{2}$a时,发生的离子反应为(b-a)NH4++aH++bOH-=(b-a)NH3•H2O+aH2O | |
| D. | 当a/2<b<a时,溶液中Na+、NH4+与H+的物质的量之比为b:a:(a-b) |
18.食物按照其在体内代谢最终产物的性质,可分为酸性食物和碱性食物.属于碱性食物的是( )
| A. | 柠檬 | B. | 牛奶 | C. | 鸡肉 | D. | 糖果 |
8.下列关于金属的冶炼叙述错误的是( )
| A. | 工业上用电解熔融的氯化钠来制备金属钠 | |
| B. | 工业上用电解熔融的氯化铝来制备金属铝 | |
| C. | 工业上用电解熔融的氯化镁来制备金属镁 | |
| D. | 工业上可用一氧化碳还原赤铁矿来制得铁 |
15.下列物质中,能使湿润的淀粉碘化钾试纸变蓝的是( )
| A. | 氯化钠溶液 | B. | 碘水 | C. | 新制盐酸 | D. | 溴化钠溶液 |
7.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.1molCl2常温下与过量NaOH溶液反应转移电子总数为 0.1NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
8.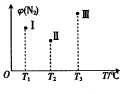 分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )
分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )
 分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )
分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )| A. | 在t min时,Ⅱ和Ⅲ一定达平衡状态 | |
| B. | 2v(NH3)=3v(H2)时,三个容器均达平衡状态 | |
| C. | 平衡后容器Ⅰ中混合气体的平均相对分子质量最小 | |
| D. | 已知tmin时,Ⅲ中c(N2)=1mol/L,此时反应平衡常数K=0.5 |