题目内容
19. 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )| 选项 | ①药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | Cl2 | NaOH溶液,尾气吸收 |
| B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | NaOH溶液,尾气吸收 |
| C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验 |
| D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 撤去 |
| A. | A | B. | B | C. | C | D. | D |
分析 装置分析可知①中的液体加入到烧瓶②中加热反应生成的气体通过装置③④除杂干燥,在装置⑤中用向上排气法收集气体,最后剩余气体在装置⑥中吸收减小尾气处理,据此原理分析选项中气体的制备、除杂、干燥、收集和尾气吸收;
解答 解:A.二氧化锰和浓盐酸加热反应生成氯气含氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,氯气比空气重可以用向上排气法收集,最后剩余氯气有毒,通入氢氧化钠溶液吸收,实验过程正确,故A正确;
B.稀硝酸和铜加热反应生成一氧化氮,气体中含硝酸蒸气和水蒸气,通过烧碱溶液吸收硝酸,通过浓硫酸干燥,一氧化氮易被空气中氧气氧化生成二氧化氮,不能用排空气法收集一氧化氮气体,故B错误;
C.浓盐酸和大理石反应生成二氧化碳气体中含氯化氢、水蒸气,通过饱和碳酸钠溶液会吸收二氧化碳,不能得到二氧化碳气体,故C错误;
D.浓盐酸和锌反应生成氢气中混有氯化氢和水蒸气,通过水吸收氯化氢,浓硫酸干燥氢气,氢气比空气轻,不能用装置⑤收集到氢气,剩余氢气点燃处理,不能散到空气中,故D错误;
故选A.
点评 本题考查了气体的制备、除杂、干燥、收集、尾气处理等试验操作,掌握气体性质是解题关键,题目较简单.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
9.有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
| A. | Mg和Zn | B. | Mg和Al | C. | Fe和Zn | D. | Cu和Fe |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | “84”消毒液中:K+、CO32-、Na+、I- | |
| B. | $\frac{K_W}{{C({H^+})}}$=1×10-13mol.L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 能使PH试纸显蓝色的溶液中:Na+、CH3COO-、Fe3+、SO42- | |
| D. | 通入足量的H2S后的溶液中:Al3+、Cu2+、SO42-、Cl- |
4.配制0.1mol/L的NaOH溶液,下列哪些操作会使实验结果偏高( )
| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
11.下列关于电解质溶液的叙述正确的是( )
| A. | 60℃时,NaCl溶液的pH<7,则溶液呈酸性 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 |
8.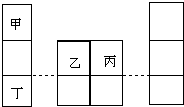 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )| A. | 简单离子半径:r(丁)>r(乙)>r(丙) | |
| B. | 元素丙的简单气态氢化物的热稳定性比乙的强 | |
| C. | 仅由甲、乙、丙三种元素形成的化合物的水溶液一定呈酸性 | |
| D. | 丙和丁形成的两种化合物中阴阳离子个数比不同 |
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.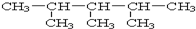 :2,3,4-三甲基戊烷.
:2,3,4-三甲基戊烷.