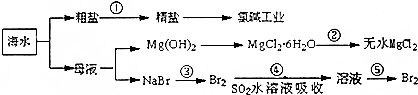
题目内容
4.配制0.1mol/L的NaOH溶液,下列哪些操作会使实验结果偏高( )| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
分析 依据c=$\frac{n}{V}$分析,凡是使溶质的物质的量n偏小或者使溶液的体积V偏大的操作都会使溶液的浓度偏小,反之,溶液的浓度偏大,据此进行解答.
解答 解:A.用滤纸称量NaOH固体,氢氧化钠能够吸收空气中的二氧化碳和水蒸气,导致称取的氢氧化钠偏少,溶质的物质的量n偏小,故A错误;
B.移液前容量瓶内有水珠,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故B错误;
C.摇匀后,液面低于刻度线,再加水至刻度线,导致溶液的体积V偏大,溶液的浓度偏低,故C错误;
D.定容时,俯视刻度线,导致溶液的体积V偏小,配制的溶液的浓度偏高,故D正确;
故选D.
点评 本题考查了配置一定物质的量浓度溶液中的误差分析,题目难度不大,明确实验操作对溶质的物质的量和溶液的体积的影响是解题关键,注意掌握配制一定物质的量浓度的溶液步骤,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
19. 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )| 选项 | ①药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | Cl2 | NaOH溶液,尾气吸收 |
| B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | NaOH溶液,尾气吸收 |
| C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验 |
| D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 撤去 |
| A. | A | B. | B | C. | C | D. | D |
9.亚硫酸钠是食品加工中广泛使用的漂白剂、防腐剂和抗氧化剂,其在食品中的残留量通常以二氧化硫含量计算.
(1)亚硫酸盐具有一定的毒性,长期摄入过量的亚硫酸盐,红细胞和血红蛋白会减少,钙的吸收也会减少,原因是SO32-与Fe2+、Ca2+结合,形成沉淀.
检验某黑木耳中是否含有亚硫酸盐的简单方法是:将黑木耳样品剪成碎末放入烧杯,加入20mL水和10mL盐酸,加热一会儿,滴入试剂A,观察现象既可.
(2)加热的作用是加快亚硫酸钠的溶解,加热时间不能太长的原因是防止亚硫酸受热分解成二氧化硫逸出.
(3)试剂A是品红溶液.
在足量的亚硫酸钠溶液中加入1~2滴液溴,振荡后溶液变为无色.
(4)写出以上反应的离子方程式3SO32-+Br2+H2O=2HSO3-+SO42-+2Br-.
(5)以上反应后的溶液中含有SO32-、HSO3-、SO42-、Br-、OH-等阴离子.设计实验检验SO42-和Br-,写出实验方法.试剂不限.
(1)亚硫酸盐具有一定的毒性,长期摄入过量的亚硫酸盐,红细胞和血红蛋白会减少,钙的吸收也会减少,原因是SO32-与Fe2+、Ca2+结合,形成沉淀.
检验某黑木耳中是否含有亚硫酸盐的简单方法是:将黑木耳样品剪成碎末放入烧杯,加入20mL水和10mL盐酸,加热一会儿,滴入试剂A,观察现象既可.
(2)加热的作用是加快亚硫酸钠的溶解,加热时间不能太长的原因是防止亚硫酸受热分解成二氧化硫逸出.
(3)试剂A是品红溶液.
在足量的亚硫酸钠溶液中加入1~2滴液溴,振荡后溶液变为无色.
(4)写出以上反应的离子方程式3SO32-+Br2+H2O=2HSO3-+SO42-+2Br-.
(5)以上反应后的溶液中含有SO32-、HSO3-、SO42-、Br-、OH-等阴离子.设计实验检验SO42-和Br-,写出实验方法.试剂不限.
| 实验操作 | 预期现象与结论 |
| 步骤1: | 有白色沉淀生成,证明待测液中含SO42- |
| 步骤2: | 溶液呈橙黄色,证明待测液中含Br- |
16.下列性质中,不能说明乙酸是弱电解质的是( )
①醋酸钠溶液的pH 大于7
②常温时,0.1mol/L乙酸溶液的pH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同pH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥pH=1的醋酸溶液用水稀释1000倍后,pH<4.
①醋酸钠溶液的pH 大于7
②常温时,0.1mol/L乙酸溶液的pH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同pH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥pH=1的醋酸溶液用水稀释1000倍后,pH<4.
| A. | ①②③ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑤ |
13.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2L0.5mol/L亚硫酸钠溶液中含有的H+离子数为2NA | |
| B. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
14.某有机物由C、H、O三种元素组成,分子球棍模型如图所示.关于该有机物叙述正确的是( )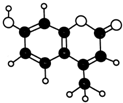

| A. | 分子式为C11H9O3 | B. | 不能使溴水褪色 | ||
| C. | 属于芳香族化合物 | D. | 不能与Na0H溶液反应 |