题目内容
11.已知如下的转化关系:(部分反应条件已略去).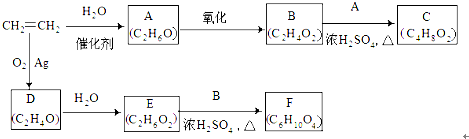
其中D为环状化合物
(1)A的名称乙醇 官能团-OH(填结构简式)
(2)写出A+B→C的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O
(3)写出A被Cu催化氧化的方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(4)A在一定条件下可生成CH2=CH2,写出反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2+H2O
(5)写出D、E、F的结构简式:D
 E
E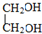 F
F 写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH(6)F的同系物M,其分子式为C4H6O4,且核磁共振氢谱只有一个峰,写出M的结构简式M
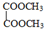 .
.
分析 根据各物质的转化关系 及有关物质的分子式可知,乙烯与水加成生成A,A为乙醇,乙醇催化氧化生成B,B为CH3COOH,乙酸与乙醇反应生成C,C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环状化合物,所以D为环氧乙烷 ,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为
,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为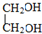 ,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯
,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯 ,据此解答.
,据此解答.
解答 解:根据各物质的转化关系 及有关物质的分子式可知,乙烯与水加成生成A,A为乙醇,乙醇催化氧化生成B,B为CH3COOH,乙酸与乙醇反应生成C,C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环状化合物,所以D为环氧乙烷 ,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为
,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为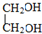 ,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯
,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯 ,
,
(1)根据上面的分析可知,A的名称为乙醇,其中的 官能团为-OH,
故答案为:乙醇;-OH;
(2)A+B→C的反应为乙酸与乙醇反应生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(3)A为乙醇,A被Cu催化氧化的方程式为 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(4)A为乙醇,A在一定条件下可生成CH2=CH2,反应方程式为CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2+H2O,
故答案为:CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2+H2O;
(5)根据上面的分析可知,D为环氧乙烷 ,E为
,E为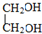 ,F为
,F为 ,C酸性条件下水解的方程式为CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$ CH3COOH+CH3CH2OH,
,C酸性条件下水解的方程式为CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$ CH3COOH+CH3CH2OH,
故答案为: ;
;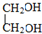 ;
; ;CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$ CH3COOH+CH3CH2OH;
;CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$ CH3COOH+CH3CH2OH;
(6)F为 ,F的同系物M,其分子式为C4H6O4,且核磁共振氢谱只有一个峰,则M的结构简式为
,F的同系物M,其分子式为C4H6O4,且核磁共振氢谱只有一个峰,则M的结构简式为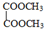 ,
,
故答案为: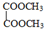 .
.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质以及学生推理能力等,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,根据乙烯与D的分子式,判断D的结构是解题的关键,难度中等,是高考热点题型.

 淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.Ⅰ.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1H2(g),此时v正<v逆(填“>”“<”或“=”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726 kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析升高温度对制备甲醇反应的影响升高温度使反应速率加快,平衡左移,CH3OH产率减小.
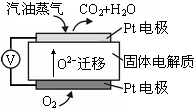
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以己烷(C6H14)代表汽油,写出该电池工作时的负极反应方程式C6H14-38e-+19O2-=6CO2+7H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成标况下氢气的体积为22.4L.
(1)用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(I)△H=-44.0kJ•mol-1
写出CH4 (g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1.
(3)①取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)?N2O4(g)△H<0.反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中如图1,可能与实验结果相符的是BD.
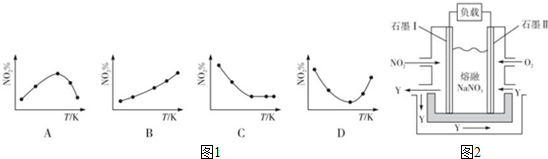
②保持温度、体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率增大(填“增大”、“减小”、“不变”或“无法确定”).
③由NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极上发生反应生成一种氧化物Y,其电极反应式NO2+NO3--e-=N2O5.
| A. | 无机物的种类比有机物多 | |
| B. | 互为同系物的有机物有可能同时互为同分异构体 | |
| C. | 丁烷有两种同分异构体 | |
| D. | 醇和醚均互为同分异构体 |
| A. | 苯中的甲苯:加溴水分液 | |
| B. | 乙醇中的水:加新制CaO蒸馏 | |
| C. | 甲烷中的乙烯:用溴的四氯化碳溶液洗气 | |
| D. | 乙酸乙酯中的乙酸:加饱和Na2CO3溶液分液 |
| A. | 用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 | |
| B. | 配制稀盐酸定容时,俯视容量瓶刻度线 | |
| C. | 滴定前尖嘴处无气泡,滴定终点时有气泡 | |
| D. | 滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下 |
(1)写出H2A的第一步电离方程式H2A=H++HA-.
(2)0.1mol/LNaHA溶液中离子浓度从大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),其中c(H+)>0.01mol/L(填“>”、“=”或“<”),
(3)写出H2A溶液与过量NaOH溶液反应的离子方程式H++HA-+2OH-=A2-+2H2O
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
②25℃时,0.01mol/LNaCN溶液的pH>7;
③在浓度均为0.01mol/L的CH3COONa、NaC10、Na2C03的混合溶液中,逐滴加人0.01mo l/LHCl,则体系中酸根离子反应的先后顺序为CO32-、ClO-、HCO3-、CH3COO-.
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同 | |
| B. | 常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应 | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO42- | |
| D. | 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+ |
| A. | 氧化铜与稀硫酸反应:O2-+2H+═H2O | |
| B. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 铜与浓硝酸的反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氢氧化钡与稀硫酸的反应:H++2SO42-+2Ba2++OH-═2BaSO4↓+H2O |