题目内容
4.下列实验方案设计中,能达到实验目的是( )| 选项 | 实验目的 | 实验方案 |
| A | 检验FeCl3溶液中是否存在FeCl2 | 向溶液中滴加KSCN溶液后再滴加氯水 |
| B | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| C | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硫酸并过滤 |
| D | 检验未知溶液一定含有CO32- | 加入稀盐酸有无色无味的气体生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.检验FeCl3溶液中是否存在FeCl2,应利用亚铁离子的还原性;
B.利用强酸制取弱酸的反应比较酸性;
C.CuO与硫酸反应,而Cu不能;
D.碳酸氢根离子与盐酸反应生成二氧化碳.
解答 解:A.检验FeCl3溶液中是否存在FeCl2,应利用亚铁离子的还原性,选择高锰酸钾,而滴加KSCN溶液后再滴加氯水不能检验亚铁离子,应原溶液中含铁离子,故A错误;
B.利用强酸制取弱酸的反应比较酸性,如二氧化碳与硅酸钠反应,而不能利用Na2CO3和SiO2在高温下熔融反应比较酸性,故B错误;
C.CuO与硫酸反应,而Cu不能,则反应后过滤可除杂,故C正确;
D.碳酸氢根离子与盐酸反应生成二氧化碳,则不能检验一定含CO32-,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的检验、酸性比较、混合物分离提纯、离子检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
6.如图表示吸热反应、置换反应、氧化还原反应之间的关系,下列反应中,属于Ⅴ区域的是( )
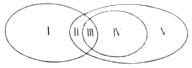

| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
10.除去下列括号内杂质的试剂和方法正确的是( )
| A. | Fe3+(Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量K2SO4溶液,过滤 | |
| C. | CO2(SO2),饱和碳酸钠溶液,浓硫酸,洗气 | |
| D. | MgCl2溶液(Fe3+):加MgO固体,过滤 |
9.将2mol X和2mol Y充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(g)+a Q(g).2min达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
16.下列实验方案的设计中,可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用萃取的方法分离煤油和汽油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 向某溶液中先加BaCl2溶液,若有白色沉淀,再加稀盐酸,沉淀不溶解,可检验其中含有SO${\;}_{4}^{2-}$ |
13.有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为A原子L层电子数的2倍.则A、B分别是( )
| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
14.有机物 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )| A. | 4 种 | B. | 5 种 | C. | 6 种 | D. | 7 种 |
 .
.